
| A. | 分子组成相差1个或若干个CH2原子团的物质互称为同系物 | |
| B. | 相对分子质量相同的有机物互为同分异构体 | |
| C. | 碳原子之间只以单键相结合的链烃为烷烃 | |
| D. | 含碳化合物一定为有机物 |
分析 A.结构相似,分子组成相差1个或若干个CH2原子团的物质互称为同系物;
B.分子式相同,结构不同的化合物互为同分异构体;
C.烷烃的分子组成只含有碳氢元素,所有的化学键为单键的链烃;
D.CO、CO2、碳酸及碳酸盐等属于无机物.
解答 解:A.结构相似,分子组成相差1个或若干个CH2原子团的物质互称为同系物,故A错误;
B.分子式相同,结构不同的化合物互为同分异构体,故B错误;
C.碳原子之间只以单键相结合的链烃中,所有的化学键都是单键,属于饱和烃,因此一定为烷烃,故C正确;
D.含碳元素的化合物不一定是有机物,如CO、CO2、碳酸及碳酸盐等属于无机物,故D错误;
故选C.
点评 本题考查了烷烃和有机物的概念以及同系物和同分异构体的判断,题目难度不大,解题的关键是明确同系物、同分异构体的含义和判断依据,然后灵活运用即可.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| C. | 铁与氯化铁溶液反应:Fe+2Fe3+═3Fe2+ | |
| D. | 氢氧化钡溶液与硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有漂白性,用SO2漂白过的草帽辫能长久持白 | |
| B. | SiO2、CO2都是酸性氧化物,都能与强碱溶液反应 | |
| C. | NO2为红棕色气体,因此,将NO2通入水中,溶液显红棕色 | |
| D. | 漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2是还原剂 | B. | HCl被还原 | ||
| C. | MnO2发生氧化反应 | D. | 每反应4molHCl转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应的化学平衡常数K值的大小和反应的温度、各组分的浓度以及体系的压强都有关 | |
| B. | 任何条件下,只要c(H+)>c(OH-),水溶液就一定显酸性 | |
| C. | 盐酸中无OH-,烧碱溶液中无H+ | |
| D. | 水的离子积常数Kw和水的电离平衡常数K电离是两个没有任何关系的物理量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{12}$% | B. | $\frac{a}{27}$% | C. | $\frac{1}{9}-\frac{a}{27}$% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 残留固体中一定不含有铁 | B. | 滤液中可能含有Fe3+ | ||
| C. | 原混合物中n(Fe)>n(Fe2O3)+n(CuO) | D. | 原混合物中铁为3.36 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
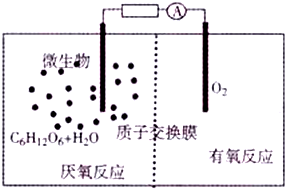 微生物电池是指在微生物的作用下将化学能转化为电能的装置(总反应方程式为C6H12O6+6O2═6CO2+6H2O),其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置(总反应方程式为C6H12O6+6O2═6CO2+6H2O),其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 正极区溶液的pH减小 | |
| B. | 微生物促进了反应中电子的转移 | |
| C. | 质子通过交换膜从负极区移向正极区6H2O+C6H12O6-24e-═6CO2+24H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
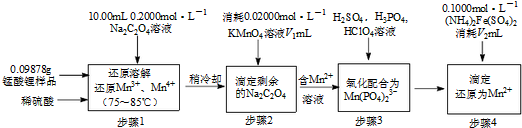
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com