
分析 (1)根据价层电子对互斥理论确定其杂化方式及空间构型;
(2)ClO2可用湿润的KClO3和草酸(固体)混合加热到60℃制得,Cl元素的化合价由+5价降低为+4价,C元素由+3价升高为+4,结合电子守恒和原子守恒分析,以此写出化学方程式;
(3)ClO2沸点9.90℃,二氧化碳沸点为-76.5℃,两者相差较大,据此分析.
解答 解:(1)ClO2中心原子氯原子3P轨道上一电子形成π键,所以价层电子对个数=2+$\frac{1}{2}$(7-2×1-1)=4,且含有2个孤电子对,所以是直线型,
故答案为:直线型;
(2)Cl元素的化合价由+5价降低为+4价,C元素由+3价升高为+4,由电子守恒和原子守恒可知,反应为:2KClO3+H2C2O4═K2CO3+2ClO2↑+H2O+CO2↑;
故答案为:2KClO3+H2C2O4═K2CO3+2ClO2↑+H2O+CO2↑;
(3)二氧化碳沸点为-76.5℃,ClO2的沸点9.90℃,沸点低,用冰水可以使ClO2冷凝为液体,收集在试管中,所以用此法制备获得的ClO2和其他生成物分离的方法是冷却,
故答案为:冷却.
点评 本题以氯及其化合物的性质考查了分子结构、氧化还原反应及物质的分离,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度不大.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I- | |
| B. | 将SO2通入品红溶液,溶液褪色,证明SO2具有氧化性 | |
| C. | 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 | |
| D. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 减压 | C. | 加压 | D. | 适当降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si与SiO2在常温下都可与NaOH溶液反应 | |
| B. | C与SiO2之间可以反应制备Si,同时得到CO | |
| C. | Si与SiO2都可以与氢氟酸反应 | |
| D. | Si→SiO2→H2SiO3可以通过一步反应实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁制品表面镀锌可以增强其抗腐蚀性 | |
| B. | 在海轮外壳上连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 有些合金比纯净的金属耐腐蚀 | |
| D. | 利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石与互为石墨同分异构体 | |
| B. | 石墨比金刚石稳定 | |
| C. | 浓硫酸与稀氢氧化钠溶液反应的中和热为-57.3kJ | |
| D. | 稀硫酸和稀Ba(OH)2溶液反应生成1molH2O时的热效应是-57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
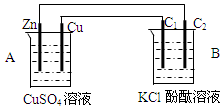 按图装置进行实验,并回答下列问题
按图装置进行实验,并回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 颜色 | 水中溶解性 |
| Fe2S3 | 黑色 | 难溶于水 |
| FeS | 黑褐色 | 难溶于水 |
| 实验步骤 | 操作 | 现象 | 备注 |
| 1 | 向2mL 0.1mol/L氯化铁溶液中逐滴滴入3滴0.1mol/L 硫化钠溶液 | 产生黑色沉淀,立即变为黄色沉淀,未见其它明显现象 | 自始至终都未见红褐色沉淀 |
| 2 | 继续滴加3滴0.1mol/L 硫化钠溶液 | 同上 | |
| 3 | 继续滴加0.1mol/L 硫化钠溶液至过量 | 产生黑色沉淀,振荡后静置,未发现明显变化 |
| 实验步骤 | 操作 | 现象 |
| 4 | 向2mL 0.1mol/L硫化钠溶液中逐滴滴入3滴0.1mol/L 氯化铁溶液 | 产生黑色沉淀,未见其它明显现象 |
| 5 | 继续滴加3滴0.1mol/L 氯化铁溶液 | 同上 |
| 6 | 继续滴加0.1mol/L 氯化铁溶液至过量 | 同上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com