
已知苯酚能跟碳酸钠溶液反应生成苯酚钠。现有如下转化:




 COOH COONa COONa COONa
COOH COONa COONa COONa




 HO—
HO—




CH2OH CH2OH CH2OH CH2ONa
根据上述转化关系回答下列问题:
(1)a.羧基 b.酚羟基 c.醇羟基提供质子的能力是(填编号)_____________________。
(2)①~⑤编号所用的试剂分别是:①_____________;②_____________;
③_______________;④________________ ;⑤________________。
(3)写出苯酚与碳酸钠溶液反应的离子方程式
_________________________________________________。
(4)写出乙醇钠与水反应的化学方程式
________________________________________________。
科目:高中化学 来源: 题型:
下列说法正确的是
A.天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点
B.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖、
C.若两种二肽互为同分异构体,则二者的水解产物不一致
D.乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体
查看答案和解析>>
科目:高中化学 来源: 题型:
100 mL 6 mol·L-1H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的(双选)( )
A.碳酸钠 B.水
C.硫酸钾溶液 D.硫酸铵
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是 ( )
A.溶液中导电粒子的数目增加,导电性增强
B.醋酸的电离程度增大,减小
C.再加入10mL pH=11 NaOH溶液,混合液pH=7
D.溶液中由水电离出的=1×10-11 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,书写正确的是 ( )
A . 弱酸酸式盐NaHB在水溶液中水解:HB–+H2O H3O++B2–
H3O++B2–
B . 电解饱和食盐水:C1-+2H2O H2↑+Cl2↑+OH-
H2↑+Cl2↑+OH-
C . 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH-
D . FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池的工作原理为: Pb+PbO2+2H2SO4===2PbSO4+2H2O。研读下图,下列判断不正确的是( )
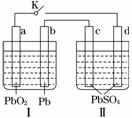
A. K闭合时,d电极反应式:PbSO4+2H2O-2e-===PbO2+4H++SO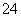
B. 当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C. K闭合时,Ⅱ中SO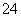 向c电极迁移
向c电极迁移
D. K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
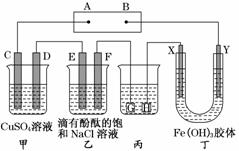
请回答:
(1)B极是电源的______________,一段时间后,甲中溶液颜色________,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明_____________________________,
在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为________。
(3)现用丙装置给铜件镀银,则H应是______________(填“镀层金属”或“镀件”),电镀液是________溶液。当乙中溶液的pH是13时 (此时乙溶液体积为500 mL),丙中镀件上析出银的质量为________,甲中溶液的pH________(填“变大”“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生的总反应的离子方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25 ℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是( )
①2CN-+H2O+CO2===2HCN+CO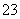
②2HCOOH+CO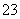 ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
③中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
④等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
A.①② B.②③
C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是()
| A. | 铁和足量稀硝酸反应 Fe+2H+═Fe2++H2↑ | |
| B. | 氯化铁溶液滴入沸水 Fe3++3H2O | |
| C. | 硝酸银溶液中滴入食盐水 Cl﹣+Ag+═AgCl↓ | |
| D. | 氯气通入烧碱溶液 Cl2+2OH﹣═Cl﹣+ClO﹣+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com