
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=+74.8 kJ•mol-1 |
分析 A.太阳光催化分解水制氢,太阳能转化为化学能;
B.反应②中△H>0;
C.催化剂不影响反应的焓变;
D.③-②得到CH4(g)+H2O(g)=CO(g)+3H2(g).
解答 解:A.太阳光催化分解水制氢,太阳能转化为化学能,没有使用电能,故A错误;
B.反应②中△H>0,为吸热反应,故B错误;
C.催化剂不影响反应的焓变,则反应③使用催化剂,△H3不变,故C错误;
D.③-②得到CH4(g)+H2O(g)=CO(g)+3H2(g)△H=(+206.1kJ.mol-l)-(+131.3kJ.mol-1)=+74.8 kJ.mol-1,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、能量转化及盖斯定律应用为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
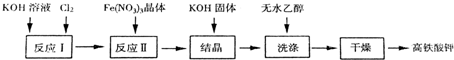
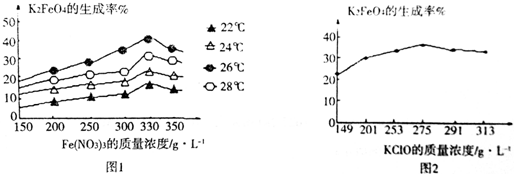
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何条件下,反应2CO2(g)═2CO(g)+O2(g)均不能自发进行 | |
| B. | 依据反应I2+2S2O32-═2I-+S4O62-,若要测定平衡体系I2+I-?I3-中平衡时的 c(I2),可用已知物质的量浓度的Na2S2O3溶液进行滴定实验 | |
| C. | 向含有苯酚的苯溶液中滴入少量浓溴水未见白色沉淀,是因为生成的三溴苯酚又溶于苯中 | |
| D. | 检验某物质是否含有Fe2O3的操作步骤是:样品粉碎→加水溶解→过滤,向滤液中滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积相同、浓度均为0.1 mol•L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n | |
| B. | 有甲、乙两氨水溶液,测得甲的pH=a,乙的pH=a+1,则甲乙两溶液c(H+)之比为10:1 | |
| C. | 相同温度下,0.2 mol•L-1乙酸溶液与0.1 mol•L-1乙酸溶液中c(H+)之比为2:1 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,K=$\frac{c{α}^{2}}{c(1-α)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,K变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
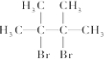
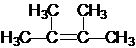 名称为2,3-二甲基-2-丁烯
名称为2,3-二甲基-2-丁烯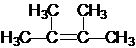 →
→
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | 90℃ | 100℃ |
| 水的离子积常数 | 1×10-14 | 3.8×10-13 | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com