
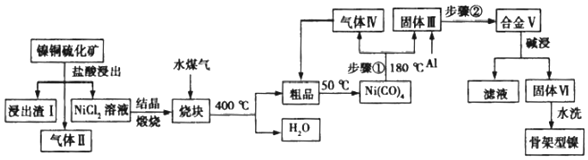
分析 镍铜硫化矿(主要成分为Ni2S 和Cu2S)用盐酸浸取,浸出渣Ⅰ的主要成分是Cu2S,Ni2S 与盐酸反应生成NiCl2和H2S和氢气,反应为:Ni2S+4HCl=NiCl2+H2S↑+H2↑,将NiCl2溶液结晶与水煤气煅烧,发生氧化还原反应得到Ni粗品,再通入CO气体,形成Ni(CO)4,Ni(CO)4180℃受热分解加热得到镍和CO,加入铝,高温熔融时通入惰性气体保护Ni、Al,得到合金,将合金“高温熔融”后冷却、粉碎,再用浓氢氧化钠溶液碱浸,铝与氢氧化钠反应产生氢气使镍铝合金产生多孔的结构,浸出液中含偏铝酸根,最后用蒸馏水洗浸出渣,得到产品镍铝合金,据此分析解答.
解答 解:(1)镍铜硫化矿酸浸所得的浸出渣Ⅰ的主要成分是Cu2S,气体Ⅱ是两种气体的混合物,则,Ni2S 与盐酸反应生成NiCl2和H2S和氢气(气体II),故反应为:Ni2S+4HCl=NiCl2+H2S↑+H2↑;
故答案为:Ni2S+4HCl=NiCl2+H2S↑+H2↑;
(2)根据分析步骤①为Ni(CO)4180℃受热分解加热得到镍和CO,反应为:Ni(CO)4$\frac{\underline{\;180℃\;}}{\;}$Ni+4CO↑;为使合金在碱浸时充分反应,加快反应速率,合金V 在碱浸前要粉碎;
故答案为:Ni(CO)4$\frac{\underline{\;180℃\;}}{\;}$Ni+4CO↑;使合金在碱浸时充分反应,加快反应速率;
(3)合金为Ni、Al合金,碱浸时选择浓NaOH 溶液,Al溶于氢氧化钠,离子反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
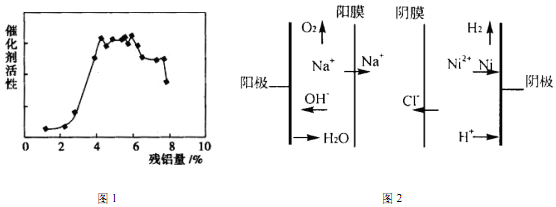
(4)图1,残铝量在4%~6%范围内催化剂活性最高,属于优质产品;
故答案为:4%~6%;
(5)阳极为氢氧根离子发生氧化反应生成氧气,反应式为:4OH--4e-=2H2O+O2↑;pH过高,镍离子形成氢氧化物沉淀,pH过低,氢离子放电较多,有氢气析出,也不利于Ni的回收,故电解过程中,需要控制溶液pH 值为4 左右;
故答案为:4OH--4e-=2H2O+O2↑;pH过高,镍离子形成氢氧化物沉淀,pH过低,有氢气析出,降低Ni的回收率;
(6)根据题意:骨架型镍催化剂因其具有多孔结构对氢气有极强吸附性,则骨架型镍的多孔结构吸收了碱浸时产生的氢气,则使用新制骨架型镍进行烯烃加氢反应,有时不加入氢气也可以完成反应;
故答案为:骨架型镍的多孔结构吸收了碱浸时产生的氢气.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、电解原理等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 酸性KMnO4溶液中通入SO2气体后紫红色消失 | |
| B. | 滴有酚酞的NaOH溶液中通入SO2气体后红色消失 | |
| C. | 品红溶液中通入SO2气体后红色消失 | |
| D. | 溴水中通入SO2气体后橙色消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池工作时,电解质溶液H2SO4的浓度不变 | |
| B. | 加水稀释0.1 mol•L-1CH3COOH溶液时,CH3COOH的电离程度增大,pH减小 | |
| C. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 | |
| D. | 标准状况下,2.24 LCCl4含有的共价键数为0.4×6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
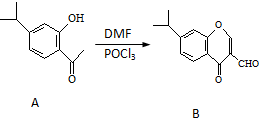 有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )| A. | 分子A中至少有8个碳原子位于同一平面 | |
| B. | 1molA与浓溴水发生取代反应时,最多消耗3molBr2 | |
| C. | 物质B既能发生银镜反应,又能发生水解反应 | |
| D. | 1mol B最多可与6mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入醋酸溶液中:CH3COOH+NH3═CH3COO-+NH4+ | |
| B. | 向苯酚纳溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| C. | 等物质的量Cl2与FeBr2在溶液反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 惰性电极电解硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气化学性质通常不活泼,可将炽热的镁粉放在氮气中冷却 | |
| B. | 明矾溶于水能形成胶体,可用于自来水的杀菌消毒 | |
| C. | 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸 | |
| D. | 金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com