
| A. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| B. | 一定温度下,pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ | |
| C. | CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大 | |
| D. | 25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度 |
分析 A.浓氨水与氯化铁反应生成氢氧化铁沉淀,不会获得胶体;
B.水解程度大小为:①CH3COONa<②NaHCO3<③NaClO,水解程度越大,溶液的pH越大,据此判断pH相同的三种溶液中钠离子浓度大小;
C.加入盐酸后,醋酸根离子与氢离子结合生成弱电解质醋酸,导致醋酸根离子浓度减小;
D.氢氧化铜在溶液中存在溶解平衡,铜离子、氢氧根离子浓度越大,溶解度越小.
解答 解:A.浓氨水和氯化铁之间会发生复分解反应生成氢氧化铁沉淀和氯化铵,不会获得胶体,故A错误;
B.水解程度大小为:①CH3COONa<②NaHCO3<③NaClO,当浓度相同时,溶液pH大小为:①<②<③,则溶液pH相同时,三者的浓度大小为:①>②>③,钠离子不水解,则溶液中的c(Na+)大小为:①>②>③,故B正确;
C.CH3COONa溶液中滴加少量浓盐酸后,醋酸根离子与氢离子反应生成醋酸,则c(CH3COO-)减小,故C错误;
D.25℃时,由于硝酸铜电离出的铜离子抑制了氢氧化铜的溶解,则Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度,故D正确;
故选BD.
点评 本题考查了离子浓度大小比较、难溶物溶解平衡的应用、盐的水解原理等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CH3COO- | ||
| C. | Na+、NH4+、NO3-、S2- | D. | Na+、Ag+、NO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 指定环境 | 能够共存的离子 |
| A | 滴加酚酞显红色的溶液 | K+、S2-、SO42-、NO3- |
| B | 有HCO3-存在的溶液 | Na+、K+、C1-、A13+ |
| C | pH=1的溶液中 | C1-、CO32-、NO3-、NH4+ |
| D | 使石蕊变红的溶液中 | Fe2+、MnO4-、NO3-、SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
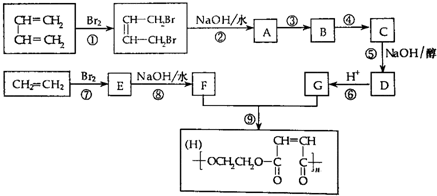
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KClO3(s)═2KCl(s)+3O2(g);△H=-78.03kJ•mol-1:△S=494.4 J•mol-1•K-1 | |
| B. | CO(g)═C(s,石墨)+$\frac{1}{2}$O2(g);△H=110.5kJ•mol-1,△S=-89.4 J•mol-1•K-1 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=-444.3kJ•mol-1,△S=-280.1 J•mol-1•K-1 | |
| D. | NH4HCO3(s)+CH3COOH(aq)═CO2(g)+CH3COONH4(aq)+H2O(l);△H=37.30kJ•mol-1,△S=184.0 J•mol-1•K-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,46gCH4中含有的分子数为NA | |
| B. | 通常状况下,14gCO含有的电子数目为7NA | |
| C. | lL0.2mol•L-1的CH3COOH溶液中,H+数目为0.2NA | |
| D. | 0.1molCu与400mLlmol•L-1稀硝酸反应后,溶液中的NO3数目为为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 | |
| B. | 反应Hg(1)+H2SO4(aq)═HgSO4(aq)+H2(g)在常温下不能自发进行,则△H>0 | |
| C. | 将纯水加热至较高温度,Kw变大、pH变小、呈酸性 | |
| D. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I-和IO-都是该反应的催化剂 | |
| B. | H2O2分解的速率取决于第二步反应的快慢 | |
| C. | 反应物的总能量比生成物总能量低98kJ | |
| D. | 第一步H2O2被还原,第二步H2O2被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷通常是由溴跟乙烷直接反应来制取 | |
| B. | 在溴乙烷中滴入硝酸银,立即析出浅黄色沉淀 | |
| C. | 溴乙烷跟KOH的醇溶液加热反应生成乙醇 | |
| D. | 溴乙烷不溶于水,溶于有机溶剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com