
| A. |  | B. |  | ||
| C. |  | D. |  |
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:填空题
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/0C | 78.5 | 132 | 34.6 |
| 熔点/0C | -130 | 9 | -116 |
| 溶解性 | 易溶水 | 难溶水 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃不能发生加成反应,烯烃不能发生取代反应 | |
| B. | 烷烃中含饱和键、烯烃、炔烃中含不饱和键 | |
| C. | 能发生加成反应的一定是烯烃 | |
| D. | 符合通式CnH2n+2的一定是烷烃,符合通式CnH2n的一定是烯烃. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质:⑥⑦ | B. | 氧化物:②⑨ | C. | 碱:①④ | D. | 有机物:③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铵固体 | B. | 硫酸钾溶液 | C. | NaHSO4固体 | D. | Na2CO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋 | |
| C. | 二氧化硅可用于制备太阳能电池板 | |
| D. | 装饰材料释放的甲醛会造成污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


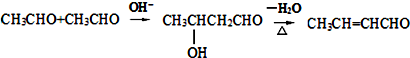
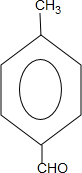 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +nH2O.
+nH2O.
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com