
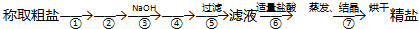
分析 称取粗盐后,应先将粗盐溶解,然后加入除杂试剂BaCl2、NaOH和Na2CO3,过滤,然后加盐酸,再蒸发结晶即可.由于Na2CO3不但要除去CaCl2,还要除去过量的BaCl2,故BaCl2的加入一定要在Na2CO3之前,而③加入的是NaOH,故②加入的是BaCl2,④加入的是Na2CO3.据此分析.
解答 解:(1)称取粗盐后,应先将粗盐溶解,然后加入除杂试剂BaCl2、NaOH和Na2CO3,过滤,然后加盐酸,再蒸发结晶即可.由于Na2CO3不但要除去CaCl2,还要除去过量的BaCl2,故BaCl2的加入一定要在Na2CO3之前,而③加入的是NaOH,故②加入的是BaCl2,④加入的是Na2CO3.故答案为:溶解;BaCl2;
(2)第④步加入的是Na2CO3,加入Na2CO3的目的是要除去CaCl2和过量的BaCl2,故离子方程式为:Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓,
故答案为:Na2CO3;Ba2++CO32-=BaCO3↓,Ca2++CO32-=CaCO3↓;
(3)过滤操作用到的主要仪器有:铁架台、烧杯、漏斗和玻璃棒,其中玻璃仪器有烧杯、漏斗和玻璃棒,故答案为:漏斗.
点评 本题考查了粗盐的除杂提纯,难度不大,应注意的是试剂加入顺序的分析,即BaCl2的加入一定要在Na2CO3之前.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1 | B. | 0.02mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
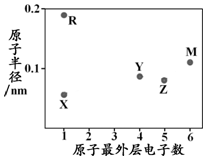
| A. | 简单阳离子半径:X<R | B. | 最高价含氧酸的酸性:Z<Y | ||
| C. | M的氢化物常温常压下为气体 | D. | X与Y可以形成正四面体结构的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制备溴苯可用如图所示装置.填空:
实验室制备溴苯可用如图所示装置.填空: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2NH3(g)△H=-92kJ/mol.
2NH3(g)△H=-92kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ④⑤②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
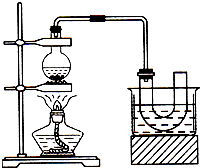 实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):
实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com