
| 0.01mol?L-1KIO3酸性溶液的体积/mL | 0.01mol?L-1KI溶液的体积/mL | H2O的体积 /mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | 5 | 5 | 25 | t1 |
| 实验2 | 4 | 5 | V1 | 25 | t2 |
| 实验3 | 5 | 5 | 5 | 35 | t3 |

| n |
| V |
| 5 |
| 6 |
| 0.005mol |
| 0.01L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同主族元素形成的单质熔沸点自上而下逐渐升高 |
| B、核外电子排布相同的微粒化学性质不一定相同 |
| C、同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| D、非金属元素的气态氢化物的稳定性越强其沸点就越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② | ③NaOH ④ | ⑤Na2SO ⑥ | ⑦SO2 ⑧Na2O | ⑨HCl ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:


 的相对分子质量大2,则符合下列条件的G的同分异构体有
的相对分子质量大2,则符合下列条件的G的同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在潮湿疏松的碱性土壤中 |
| B、在含铁元素较多的酸性土壤中 |
| C、在干燥致密不透气的土壤中 |
| D、在含碳粒较多,潮湿透气的中性土壤中 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 +R′-Cl→
+R′-Cl→ +HCl
+HCl
| KOH |


查看答案和解析>>
科目:高中化学 来源: 题型:
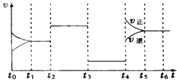 (1)已知下列反应:
(1)已知下列反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com