
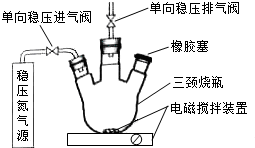
 水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg•L-1.我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg•L-1.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.
水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg•L-1.我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg•L-1.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.分析 (1)配制以上无氧溶液时需要通过煮沸溶液把溶剂中溶解的氧气赶出;
(2)加入水样需要避免空气进入三颈瓶,橡皮塞处用注射器把水样注入;
(3)搅拌的作用是混合均匀反应充分;
(4)MnO(OH)2+I-+H+→Mn2++I2+H2O,反应中碘元素化合价-1价变化为0价,锰元素化合价降低+4价变化为+2价,电子转移总数2,结合原子守恒配平离子方程式;
(5)为减少实验过程中的误差,滴定实验应重复进行滴定实验测定数值,取几次的平均值计算;
(6)用Na2S2O3标准溶液滴定生成的I2发生反应2S2O32-+I2═S4O62-+2I-,指示剂为淀粉,随滴入溶液反应溶液蓝色变化为无色且半分钟不变说明反应达到终点;用Na2S2O3标准溶液滴定生成的I2发生反应2S2O32-+I2═S4O62-+2I-,以淀粉作指示剂,随硫代硫酸钠溶液滴入,滴定过程中滴入最后一滴溶液蓝色变化为无色且半分钟不变说明反应达到终点,若某次滴定消耗Na2S2O3溶液4.50mL,2Mn2++O2+4OH-═2MnO(OH)2↓,MnO(OH)2+2I-+4H+=Mn2++I2+3H2O,2S2O32-+I2═S4O62-+2I-,得到定量关系计算得到水样中的DO,注意溶液体积的变化;
(7)硫代硫酸钠在酸性条件下发生歧化反应,生成的二氧化硫也能够被生成的碘氧化,同时空气中的氧气也能够将碘离子氧化.
解答 解:(1)溶液中氧气溶解度不大,且随温度升高溶解度减小,所以配制以上无氧溶液时需要通过煮沸溶剂后冷却,把溶剂水中溶解的氧气赶出得到,
故答案为:将溶剂水煮沸后冷却;
(2)加入水样需要避免空气进入三颈瓶,橡皮塞处用中注射器把水样注入,在橡胶塞处加入水样及有关试剂应选择的仪器是②,滴定管和量筒无法实现加入水样的目的,
故答案为:②;
(3)操作步骤中搅拌的作用是使溶液混合均匀,快速完成反应,
故答案为:使溶液混合均匀,快速完成反应;
(4)MnO(OH)2+I-+H+→Mn2++I2+H2O,MnO(OH)2+I-+H+→Mn2++I2+H2O,反应中碘元素化合价-1价变化为0价,锰元素化合价降低+4价变化为+2价,电子转移总数2,配平得到离子方程式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O,
故答案为:1,2,4,1,1,3;
(5)为减少实验过程中的误差,滴定实验应重复进行滴定实验测定数值,取几次的平均值计算,步骤f为重复步骤e的操作2-3次,
故答案为:重复步骤e的操作2-3次;
(6)用Na2S2O3标准溶液滴定生成的I2发生反应2S2O32-+I2═S4O62-+2I-,以淀粉作指示剂,随硫代硫酸钠溶液滴入,滴定过程中滴入最后一滴溶液蓝色变化为无色且半分钟不变说明反应达到终点,若某次滴定消耗Na2S2O3溶液4.50mL,2Mn2++O2+4OH-═2MnO(OH)2↓,MnO(OH)2+2I-+4H+=Mn2++I2+3H2O,2S2O32-+I2═S4O62-+2I-,得到定量关系为:
O2~2MnO(OH)2~2I2~4S2O32-,
1 4
n 0.0045L×0.01000mol•L-1
n=1.12×10-5mol,
200mL水样中含氧气1.12×10-5mol×$\frac{200}{40}$=5.6×10-5mol
氧气浓度=$\frac{5.6×1{0}^{-5}mol}{0.2L}$=2.8×10-4mol/L,
水中溶氧量(DO)=2.8×10-4mol/L×32g/mol=8.96×10-3g/L≈9.0mg/L>5 mg/L,生活饮用水源的DO不能低于5mg•L-1.则此水样符合标准,
故答案为:溶液蓝色褪去且半分钟内不变化;9.0;是;
(7)硫代硫酸钠在酸性条件下发生歧化反应,生成的二氧化硫也能够被生成的碘氧化,同时空气中的氧气也能够将碘离子氧化,反应的离子方程式分别为:2H++S2O32-=S↓+SO2↑+H2O;SO2+I2+2H2O=4H++SO42-+2I-;4H++4I-+O2=2I2+2H2O,
故答案为:2H++S2O32-=S↓+SO2↑+H2O,SO2+I2+2H2O=4H++SO42-+2I-,4H++4I-+O2=2I2+2H2O.
点评 本题考查了物质含量的测定、滴定实验及其计算的相关知识、氧化还原反应电子守恒应用,主要是实验基本操作、滴定实验的步骤、水样DO的计算应用,掌握基础是解题关键,题目难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | n:(n+1) | C. | 1:(n+1) | D. | (n+1):n |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 | 0.2 mol•L-1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
| 0.2 mol•L-1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
| 0.1 mol•L-1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||

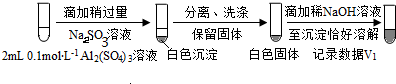
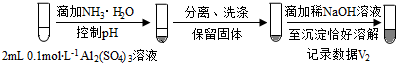 (按图形式呈现).
(按图形式呈现).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能够降低化学反应的反应热(△H) | |
| B. | 金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 | |
| C. | 原电池中发生的反应达平衡时,该电池仍有电流产生 | |
| D. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 储热材料是一类重要的存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较大的热量 | |
| B. | Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池 | |
| C. | Ba2+浓度较高时危害健康,但BaSO4可服入体内,作为造影剂用于X-射线检查肠胃道疾病 | |
| D. | 纳米铁粉可以高效地去除被污染水体中的Pb2+,Cu2+,Cd2+,Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该醇至少含有两个碳原子 | B. | 该醇分子中一定没有甲基 | ||
| C. | 该醇分子中一定含有甲基 | D. | 该醇分子中含有一个醇羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入过量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- | |
| D. | 加入过量NaClO溶液和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO | B. | CH3CH2CHO | C. | CH3COCH3 | D. | CH3CH2CH2CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com