
锂~碘电池可用来为心脏起搏器提供能源,其电池反应可简化为:2Li + I2 = 2LiI。下列有关说法正确的是
A.I2发生氧化反应 B.碘电极为该电池的正极
C.正极反应为:Li – 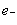 = Li+ D.该电池放电时化学能转化为电能
= Li+ D.该电池放电时化学能转化为电能
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
将钠、镁各O.2 m01分别放入100 mL 1 mol/l的盐酸中, 同温同压下产生的气体体积之比是 ( )
A.1:2 B.1:3 C.2:1 D.1:l
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:
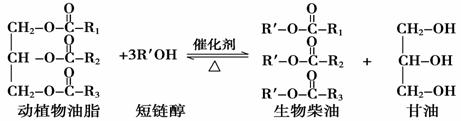
下列叙述错误的是( )
A.生物柴油由可再生资源制得 B.生物柴油是不同酯组成的混合物
C.动植物油脂是高分子化合物 D.“地沟油”可用于制备生物柴油
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是反应2A + 3B = C + 4D在不同时刻测得的速率,其中最快的是
A.V(A)=0.6mol/L.s B.V(B)=0.9mol/L.s
C.V(C)=0.4mol/L.s D.V(D)=1.0mol/L.s
查看答案和解析>>
科目:高中化学 来源: 题型:
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视。
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视。
(1)目前工业上有一种方法是用CO2来生产甲醇:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
右图表示该反应进行过程中能量(单位为kJ·mol-1)的
|
 变化。该反应是 (填“吸热”或“放热”)反应。
变化。该反应是 (填“吸热”或“放热”)反应。 (2)某温度下,若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如下图实线所示(图中字母后的数字表示对应的坐标)。
 ①在反应进行的0~1min内,该反应的
①在反应进行的0~1min内,该反应的
平均速率v(H2)= 。
②如果改变影响化学平衡的一个因素
(如:温度、浓度、压强),反应将向着能够
减弱这种改变的方向进行(如增大H2的浓度,
反应向右进行以减弱外界条件增大H2的浓度
的影响)直至达到新的平衡。若上述反应体系
不改变反应物的物质的量,仅分别改变某一实
验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I改变的实验条件是 ,曲线Ⅱ改变的实验条件是 。
(3)下列各项中,不能够说明CO2(g)+3H2(g)  CH3OH(g)+H2O(g)已达到平衡的是
CH3OH(g)+H2O(g)已达到平衡的是
(单选)。
A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH3OH消耗的速率和CH3OH生成的速率相等
C.一定条件下,H2O(g)的浓度保持不变
D.一定条件下,单位时间内消耗1 mol CO2,同时生成1 mol CH3OH
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温下,23 g NO2 含有nA 个氧原 子
子
B.1 L 0.1 mol/L氨水含有0.1nA个OH-
mol/L氨水含有0.1nA个OH-
C.常温常压下,22.4 L CCl4含有nA个CCl4分子
D.1 mol Fe2+与足量的 H2O2溶液反应,转移2nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
关于原子序数从11依次增加到17的元素,下列叙述错误的是( )
A、电子层数逐渐增多
B、原子半径逐渐减少
C、最高正价数值逐渐增大
D、从硅到氯负价-4→-1
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ、(7分)在一定条件下,将 2 molA 和 2 molB 混合于容积为 2L 的密闭容器中,发生如下反应:
3A ( g ) + B ( g ) xC ( g ) + 2D ( g )。 2 min 末反应达到平衡状态时,生成 0.8molD ,同时测得 C 的浓度为 0.4 mol·L一1。请填写下列空白:
xC ( g ) + 2D ( g )。 2 min 末反应达到平衡状态时,生成 0.8molD ,同时测得 C 的浓度为 0.4 mol·L一1。请填写下列空白:
(1)x =_________;用 D 的浓度变化表示的化学反应速率为___________________
(2)A 的平衡浓度为_______________________ , B 的转化率为_____________。
(3)如果增大体系的压强,则平衡体系中 C 的体积分数将____________(填“增大”、“减小”或“不变”)。
Ⅱ、(12分)在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:CO2(g)+H2(g)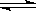 CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应
CO(g)+H2O(g)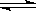 CO2(g)+H2(g)的平衡常数K2=________,
CO2(g)+H2(g)的平衡常数K2=________,
反应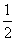 CO2(g)+
CO2(g)+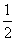 H2(g)
H2(g)
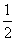 CO(g)+
CO(g)+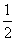 H2O(g)的平衡常数K3=________。
H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2 D.混合气体的平均相对分子质量不变
(5)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v(正)________v(逆)(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com