
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是

A. 正极反应为AgCl+e-===Ag+Cl-
B. 负极反应为Ag-e-===Ag+
C. 放电时,交换膜右侧溶液中有大量白色沉淀生成
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
【答案】D
【解析】本题考查原电池相关知识。解答时抓住原电池的工作原理进行完成,由电池总反应为2Ag+Cl2===2AgCl分析正极发生的是还原反应,电极反应式是Cl2+2e-=2Cl-,负极发生的是氧化反应,电极反应式为Ag-e-+Cl-=AgCl;根据电子守恒规律判断溶液中离子的变化。
A.该原电池正极的电极反应式是Cl2+2e-=2Cl-,故A错误;B.根据电池总反应为2Ag+Cl2=2AgCl 知负极电极反应式为Ag-e-+Cl-=AgCl,故B 错误;C.Ag+在左侧,所以在左侧生成白色沉淀故C错误;D.参加电极反应的是Cl2和Ag,左侧溶液发生的电极反应式是:Ag-e-+Cl-=AgCl,当电路中转移0.01mol电子时,Cl-减少0.01mol,同时有0.01mol的H+移向右侧,故离子共减少0.02mol,故D正确


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为:N2+3H2![]() 2NH3,该反应在一定条件下的密闭容器中进行。下列关于该反应的说法正确的是( )
2NH3,该反应在一定条件下的密闭容器中进行。下列关于该反应的说法正确的是( )
A. 达到平衡时,反应速率:v(正)=v(逆)=0
B. 使用催化剂可加快反应速率,提高生产效率
C. 为了提高H2的转化率,应适当增大H2的浓度
D. 若在密闭容器加入1molN2和过量的H2,最后能生成2molNH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近两年流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品。苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为![]() ,下列说法不正确的是
,下列说法不正确的是
A. 苹果酸在一定条件下能发生酯化反应
B. 苹果酸在一定条件下能发生催化氧化反应
C. 苹果酸在一定条件下能发生取代反应
D. 1 mol苹果酸与Na2CO3溶液反应最多消耗1 mol Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产需要大量原料,消耗大量能源,在得到所需产品同时产生了大量废气、废水、废渣。某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:
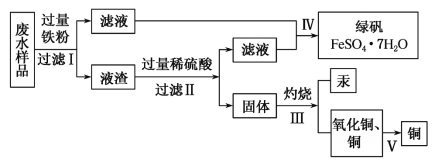
(1)现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是__________设计简单实验检验绿矾是否变质,简述你的操作:__________。
(2)步骤Ⅰ中加入过量铁粉的目的是__________,步骤Ⅱ中__________(填“能”或“不能”)用盐酸代替硫酸。
(3)步骤V利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;
方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。
从安全角度考虑,方案__________不好;从产品纯度考虑,方案__________不好。
(4)写出步骤Ⅱ中涉及反应的离子方程式:__________;步骤Ⅳ得到绿矾的操作蒸发浓缩__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)M2R4(g),加入1mol M2和2molR2 , 反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( )
A.M2既可能为固体,也可能为气体
B.达到平衡后,保持容器容枳和温度不变,再加入1molM2和2molR2 , 则R2转化率不变
C.达到平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,R2的浓度可能是原平衡时的1.8倍
D.若M2为气体,达到平衡后,保持容器容积和温度不变,再加入1molM2R4 , 则新的平衡时气体的平均相对分子质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
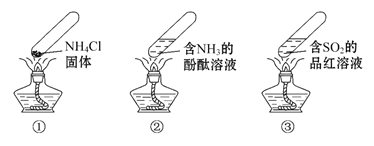
A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
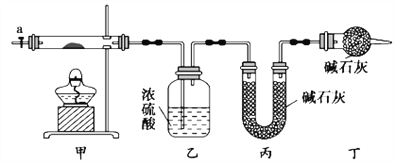
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中____________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_______________。
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_______(填字母)连接在__________(填装置连接位置)。
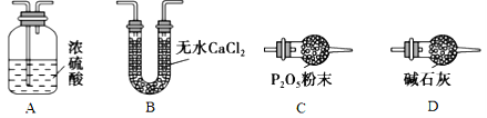
(4)若按正确装置进行实验,测得如下数据:则该碱式碳酸钴的化学式为______________。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
(5)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
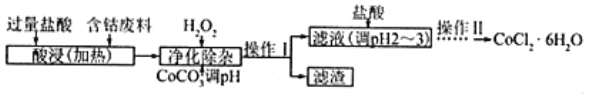
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2发生反应的离子方程式为_____________。
②加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________________。
③加盐酸调整pH为2~3的目的为_________________。
④操作Ⅱ过程为_______________(填操作名称)、过滤。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com