
 实验室里除去乙醇中混有的少量水,常采用先加入少量新制的生石灰,然后蒸馏的方法.所用装置如图.
实验室里除去乙醇中混有的少量水,常采用先加入少量新制的生石灰,然后蒸馏的方法.所用装置如图.分析 (1)根据仪器的形状确定名称;
(2)采取“逆流”的方式,可使冷凝管内始终充满了流动的水;
(3)0.1mol乙醇分子中有6molH原子,能够转化为H2的只有0.1mol;
(4)K2Cr2O7中+6价的Cr转化为Cr3+发生了还原反应;乙醇能被氧气氧化为乙醛.
解答 解:(1)A为蒸馏烧瓶,B为冷凝管,故答案为:蒸馏烧瓶;冷凝管;
(2)采取“逆流”的方式,可使冷凝管内始终充满了流动的水,到达充分冷凝的效果,故答案为:充分冷凝流经冷凝管的气体;
(3)0.1mol乙醇分子中有6molH原子,能够转化为H2的只有0.1mol,说明乙醇分子中只有羟基上的氢才能生成氢气,故答案为:B;
(4)K2Cr2O7中+6价的Cr转化为Cr3+发生了还原反应,所以乙醇表现出了还原性.在乙醇的催化氧化反应中,乙醇的氧化产物是乙醛:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,故答案为:还原性;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查物质的分离提纯和有机物的性质实验,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:Br2常温下呈液态,易挥发,有毒;如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置.其实验步骤如下:
已知:Br2常温下呈液态,易挥发,有毒;如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置.其实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为H2O的沸点比H2S高,所以O原子得电子能力大于S原子 | |
| B. | 因为F原子得电子能力比Cl原子强,所以氢氟酸属于强酸 | |
| C. | 因为H2CO3酸性大于H2SiO3,所以CH4稳定性大于SiH4 | |
| D. | 因为Na+KCl(熔融)=NaCl+K↑,所以Na原子失电子能力大于K原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是高级脂肪酸和甘油形成的酯,属纯净物 | |
| B. | 油脂都不能与溴水反应 | |
| C. | 油脂的硬化属于酯化反应 | |
| D. | 天然油脂没有恒定的熔沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;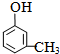 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com