
| A. | 金属阳离子与自由电子间的作用较弱 | |
| B. | 金属在外加电场作用下可失去电子 | |
| C. | 金属阳离子在外加电场作用下可发生定向移动 | |
| D. | 自由电子在外加电场作用下可发生定向移动 |
科目:高中化学 来源: 题型:选择题
| A. | 1mol的氨气与1mol的铵根离子所含电子数、质子数均为10NA | |
| B. | 14g乙烯和14g聚乙烯所含的原子数均为3NA | |
| C. | 标准状况下,11.2LCH3CH20H中含有的C-H键的个数为2.5NA | |
| D. | 1L1mol•L-1的NaAl02溶液中含有Al02-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌 | B. | 铁 | C. | 镁 | D. | 铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
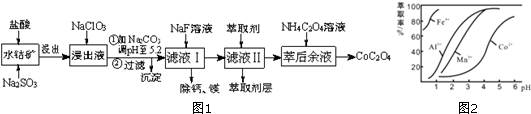
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V L该气体的质量(以g为单位) | B. | 1 L该气体的质量(以g为单位) | ||
| C. | 1 mol该气体的体积(以L为单位) | D. | 1 L该气体的物质的量(以mol为单位) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
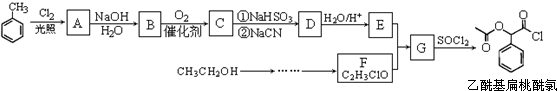
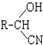 ,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′
,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′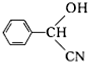 ,E中含氧官能团的名称醇羟基和羧基.
,E中含氧官能团的名称醇羟基和羧基.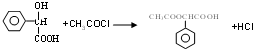 .
.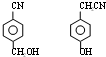 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [NH4+]=[SO42-] | B. | [NH4+]>[SO42-] | ||
| C. | [NH4+]<[SO42-] | D. | [OH-]+[SO42-]=[H+]+[NH4+] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠溶液容易吸收空气中CO2变质而生成硅酸 | |
| B. | Fe与Cl2反应生成FeCl3,Fe与S反应生成FeS | |
| C. | 实验室盛放NaOH溶液时不能使用玻璃塞,应该用橡胶塞 | |
| D. | 加碘食盐能使淀粉溶液变蓝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com