
(18分)铁是广泛应用的金属。
(1)铁元素在周期表中的位置是 ,工业上通常采用高炉炼铁的方法制得单质铁,请写出用赤铁矿与CO反应炼铁的化学方程式 。
(2)请补充完成实验室制备Fe(OH)3胶体的操作步骤:
①取25ml蒸馏水加热至沸腾
②
③继续煮沸至
④停止加热。
(3)几种离子生成氢氧化物沉淀的pH如下表(已知Fe(OH)2呈絮状,不易从溶液中除去)
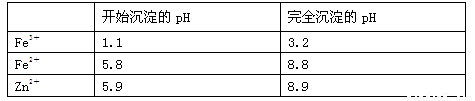
注:开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算现有某溶液含有Fe2+、Fe3+、Zn2+、SO42-,要使溶液中的Fe2+和Fe3+完全沉淀,需往溶液中先加入H2O2,作用是 ,然后再加入NH4HCO3调节pH至 ,NH4HCO3中起调节pH作用的离子是 (填离子符号)
①设计实验探究铁钉和钢钉在碱性溶液中遇到高锰酸钾时是否能发生电化学腐蚀。实验如下
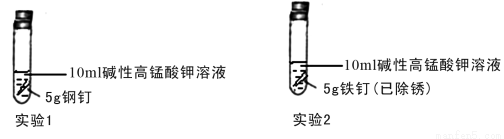
①完成下列表格
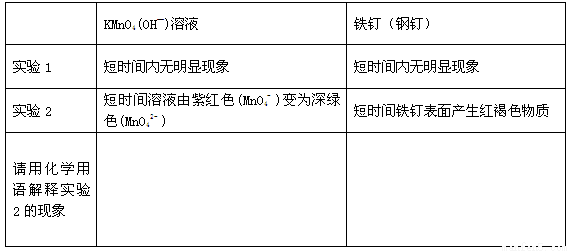
②实验2比实验1能够较快看到以上现象的原因是 。
(1)第四周期 第VIII族 (2分) 3CO + Fe2O3 2Fe +3 CO2(2分)
2Fe +3 CO2(2分)
(2)②向沸水中逐滴加入5-6滴FeCl3饱和溶液 (2分)
③液体呈透明的红褐色 (1分)
(3)将Fe2+氧化为Fe3+,(2分)至3.2-5.8之间 (1分) HCO3-(2分)
(4)①
(每道方程式1分,共4分)
②铁钉中的碳和铁构成了原电池的正负极,加快反应速率,能发生电化学腐蚀 (2分)
【解析】
试题分析:铁元素是第四周期,第VIII族元素,工业上通常采用高炉炼铁的方法制得单质铁:3CO + Fe2O3 2Fe +3 CO2;(2)实验室制备Fe(OH)3胶体的操作步骤为:①取25ml蒸馏水加热至沸腾;②向沸水中逐滴加入5-6滴FeCl3饱和溶液;③继续煮沸至液体呈透明的红褐色,即得到Fe(OH)3胶体;④停止加热。(3)含有Fe2+、Fe3+、Zn2+、SO42-的溶液中,要使溶液中的Fe2+和Fe3+完全沉淀,先往溶液中加入H2O2将Fe2+氧化为Fe3+,然后再加入NH4HCO3调节pH至3.2 以上使Fe3+完全沉淀,但pH<5.9,防止Zn2+转化为沉淀;加入NH4HCO3是使溶液中的H+离子浓度降低,故起调节pH作用的离子是HCO3- ;(4) ①钢铁中含有Fe、C,C、Fe和电解质溶液构成原电池,Fe易失电子作负极,电极反应式为Fe-2e-=Fe2+,C为正极,正极上MnO4-得电子发生还原反应,电极反应式为MnO4-+e- = MnO42-,短时间溶液由紫红色(MnO4-)变为深绿色(MnO42-),随后Fe 2++2OH- =Fe(OH)2 ↓;Fe(OH)2+2OH- + MnO4-=Fe(OH)3 +MnO42- ; Fe(OH)3 = Fe2O3 ·nH2O等反应进行,因此可知:
2Fe +3 CO2;(2)实验室制备Fe(OH)3胶体的操作步骤为:①取25ml蒸馏水加热至沸腾;②向沸水中逐滴加入5-6滴FeCl3饱和溶液;③继续煮沸至液体呈透明的红褐色,即得到Fe(OH)3胶体;④停止加热。(3)含有Fe2+、Fe3+、Zn2+、SO42-的溶液中,要使溶液中的Fe2+和Fe3+完全沉淀,先往溶液中加入H2O2将Fe2+氧化为Fe3+,然后再加入NH4HCO3调节pH至3.2 以上使Fe3+完全沉淀,但pH<5.9,防止Zn2+转化为沉淀;加入NH4HCO3是使溶液中的H+离子浓度降低,故起调节pH作用的离子是HCO3- ;(4) ①钢铁中含有Fe、C,C、Fe和电解质溶液构成原电池,Fe易失电子作负极,电极反应式为Fe-2e-=Fe2+,C为正极,正极上MnO4-得电子发生还原反应,电极反应式为MnO4-+e- = MnO42-,短时间溶液由紫红色(MnO4-)变为深绿色(MnO42-),随后Fe 2++2OH- =Fe(OH)2 ↓;Fe(OH)2+2OH- + MnO4-=Fe(OH)3 +MnO42- ; Fe(OH)3 = Fe2O3 ·nH2O等反应进行,因此可知:
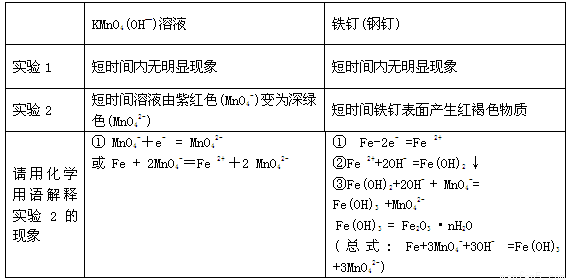
②实验2比实验1能够较快看到以上现象的原因是:铁钉中的碳和铁构成了原电池的正负极,加快反应速率,能发生电化学腐蚀。
考点:考查铁及其化合物的性质,胶体,电化学腐蚀的探究实验设计。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
| A、丙烯分子中所有原子位于同一平面 | B、丙烯分子中不存在同分异构体 | C、丙烯分子中最多有7个原子位于同一平面 | D、丙烯分子中3个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用纯碱做治疗胃酸过多的药品 | B、SiO2是制备光导纤维的主要材料 | C、用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯,以延长保质期 | D、民间用明矾作净水剂除去水中的悬浮物 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:实验题
(16分)Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为 ;向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式: 。
(2)请以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+。设计实验方案,补充完成实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
实验步骤 | 预期现象与结论 |
步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。 |
; |
步骤2: ____________________________________ ____________________________________。 |
|
(3)利用(2)提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:取少量样品溶于水, 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:选择题
下列分离、提纯、鉴别物质的方法正确的是
A. 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
B. 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C. 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D. 用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:选择题
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中Q单质可制成半导体材料。下列判断正确的是
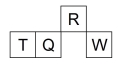
A.W形成的离子半径大于T形成的离子半径
B.W的单质在过量氧气中燃烧生成WO3
C.最高价氧化物的水化物的酸性:R<Q
D.T是地壳中含量最多的金属元素,其单质的化学性质较活泼
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:填空题
(16分)铜及其化合物在生产和生活实际中应用广泛。
Ⅰ.某学习小组对粗铜提纯(电解精炼)后的阳极泥(主要成分为银、金)进行如下实验。
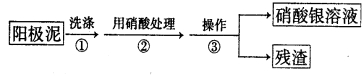
(1)操作③所需的仪器有:烧杯、 。
(2)稀硝酸处理阳极泥得到硝酸银稀溶液,写出该步反应的化学方程式_____ _。
(3)为了回收金,他们查阅了有关资料如下表:
编号 | 常温下反应 | 化学平衡常数 |
反应1 | Au + 6HNO3 | <10?5 |
反应2 | Au3+ + Cl? | >105 |
从资料中可知,常温下金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸体积比为1∶3的混合物)。请你运用化学平衡移动原理,简要说明金能溶于王水的原因: 。
Ⅱ.实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:
请回答有关问题:

(4)甲方案:将6.4g铜丝放到90 mL 1.5 mol·L-1的稀硫酸中,控温在50℃。加入40 mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4·5H2O 20.0 g【已知有关摩尔质量:M(Cu)=64 g/mol, M(CuSO4·5H2O) =250 g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4·5H2O的产率为 。
(5)乙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的 (填序号);
A.CaO B.NaOH C.CuCO3 D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是 ;
(6)丙方案:为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)= 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列各溶液中,微粒的物质的量浓度关系正确的是
A. 常温下,将pH=2的盐酸和pH=12的氨水等体积混合: c(NH4+)>c(Cl-)> c(OH-)>c(H+)
B. 0.1mol·L-1 Na2CO3溶液:c(Na+)=c(HCO3-)+2c(CO32-)+2c(H2CO3)
C. 0.1mol·L-1 NH4Cl溶液:c(NH4+)=c( Cl-)
D. 向醋酸钠溶液加适量醋酸,得到的混合溶液:c(Na+)+ c(H+)=c(CH3COO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是
A.在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
B.司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金
C.聚酯纤维、碳纤维、光导纤维都属于有机高分子材料
D.石蜡油受热分解产生了可以使酸性高锰酸钾溶液褪色的烯烃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com