
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源:2015-2016学年江西省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列事实不能用元素周期律解释的只有( )
A. 碱性:KOH>NaOH
B. 相对原子质量:Ar>K
C. 酸性:HClO4>H2SO4
D. 元素的金属性:Mg>Al
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省扬州市高二选修下学期期末调研化学试卷(解析版) 题型:选择题
下列有关物质性质的应用正确的是
A. 液氨汽化时要吸收大量的热,可用作制冷剂
B. 氯化钠是电解质,可电解其水溶液获得金属钠
C. SO2有还原性,常用来漂白纸浆
D. 四氯化碳密度比水大,可用于萃取溴水中的溴
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
对于工业合成氨反应:N2+3H2 2NH3,下列说法错误的是
2NH3,下列说法错误的是
A.使用合适的催化剂可以加大反应速率
B.升高温度可以增大反应速率
C.无论如何增大H2浓度,都不能使N2转化率达到100%
D.缩小体积,v正增大,v逆减少,平衡正向移动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
不能用化学键的牢固程度解释的是
A.金属Na熔沸点高于金属K
B.非金属性N>P,但是单质活泼性:氮气<白磷
C.相同条件下,NH3在水中的溶解度大于PH3
D.SiC晶体的熔点比晶体硅的高
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:实验题
I、今有A.醋酸,B.盐酸,C.硫酸三种酸,请用三种酸的序号和“>”“<”或“=”填空。
(1)在同体积,同pH的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是 。
(2)物质的量浓度均为0.1 mol/L的三种酸溶液的pH由大到小的顺序是 ;如果取等体积的0.1 mol/L的三种酸溶液,用0.1 mol/L的NaOH中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 。
II、用实验确定某酸HB的弱电解质。两同学的方案是:
甲:①称取一定质量的HB配制0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HB是弱电解质。
乙:①用已知物质的量浓度的HB溶液、盐酸,分别配制pH = 1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HB是弱电解质。
(1)甲方案中,说明HB是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
(2)请你评价乙方案中难以实现之处和不妥之处: 。
III、硼酸(H3BO3)是生产其它硼化物的基本原料。已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液, (填“能”或“不能”)观察到气泡逸出。
已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式 。
【答案】I、(1)a>b=c ;(2)a>b>c ;c>b=a ;
II 、(1)>;(2)配制pH=1的溶液难以实现,加入的锌粒难以做到表面积相同 ;
III、不能; H3BO3+H2O B(OH)4-+H+。
B(OH)4-+H+。
【解析】
试题分析:I、醋酸和盐酸都是一元酸,醋酸是弱酸,盐酸是强酸,硫酸是二元强酸,所以醋酸中存在电离平衡,氯化氢和硫酸完全电离。(1)同体积、同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,分别加入足量的碳酸钠粉末,氢离子的物质的量越大,生成的二氧化碳体积越大,硫酸和盐酸中生成的二氧化碳体积相同,醋酸中生成的二氧化碳体积最大,所以在相同条件下产生CO2的体积由大到小的顺序是a>b=c;(2)氢离子浓度越大,溶液的pH越小,物质的量浓度为0.1mol•L-1的三种酸溶液,硫酸中氢离子浓度最大,盐酸中氢离子浓度次之,醋酸中氢离子浓度最小,所以三种酸溶液的pH由大到小的顺序是a>b>c;盐酸和醋酸都是一元酸,硫酸是二元酸,等体积、等物质的量浓度的三种酸与碱反应时,消耗碱的物质的量与酸的物质的量和元数成正比,所以硫酸消耗氢氧化钠最多,盐酸和醋酸消耗氢氧化钠的量相等,即 c>a=b;II、(1)弱酸在水溶液里部分电离,所以氢离子浓度小于酸浓度,如果该酸是弱酸,则0.1mol/L的HB溶液的pH>1;(2)HB是弱酸存在电离平衡,所以配制pH=1的HA溶液难以实现,反应物的接触面积与反应速率成正比,锌粒的表面积大小难以控制,所以实现较困难。故答案为:配制pH=1的HA溶液难以实现,加入锌粒难以做到表面积相同;III、(1)H3BO3的电离常数为5.8×10-10 ,H2CO3的电离常数为K1=4.4×10-7,因5.8×10-10<4.4×10-7,所以不能观察到气泡逸出;(2)硼酸电离出四羟基和硼酸根和氢离子,方程式为:H3BO3+H2O B(OH)4-+H+。
B(OH)4-+H+。
考点:考查强、弱电解质的电离比较、弱电解质电离方程式的书写的知识。
【题型】填空题
【适用】较难
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
I、向草酸(H2C2O4)溶液中滴加硫酸酸化高锰酸钾溶液,研究浓度对化学反应速率的影响,请你写出该反应的化学方程式 。
II、某同学根据外界条件对化学反应速率的影响原理,设计了硫代硫酸钠与硫酸反应有关实验,
实验过程的数据记录如下表,请结合表中信息,回答有关问题:
实验序号 | 反应温度(℃) | 参加反应的物质 | ||||
Na2S2O3 | H2SO4 | H2O | ||||
V/ml | c/mol·L-1 | V/ml | c/mol·L-1 | V/ml | ||
A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
(1)写出上述反应的离子方程式 。
(2)①能说明温度对该反应速率影响的组合比较是 ;(填实验序号)
②A和B、A和C的组合比较所研究的问题是 。
(3)教材是利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小的可能原因: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度
B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液pH约为12
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
【答案】C
【解析】
试题分析:A.醋酸在溶液中存在电离平衡:CH3COOH CH3COO-+H+,当想稀醋酸中加入少量醋酸钠固体时,溶液中c(CH3COO-)增大,醋酸的电离平衡逆向移动,从而减小了醋酸的电离程度,正确;B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液中c(OH-)=(0.02 mol·L-1×2-0.02 mol·L-1)÷2=0.01mol/L,由于在室温下水的离子积常数是10-14,所以c(H+)=10-12mol/L,故溶液pH约为12,正确;C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,第一种溶液中氢离子的浓度是第二种溶液中氢离子浓度的10倍。由于溶液的浓度越大,其电离程度就越小,所以则c1>10c2,错误;D.pH=11的NaOH溶液的氢氧根离子的浓度与pH=3的醋酸溶液中氢离子的浓度相等。由于醋酸是弱酸,主要以电解质分子存在,在溶液中存在电离平衡,党二者等体积混合后,由于醋酸过量,溶液显酸性,滴入石蕊溶液时,溶液呈红色,正确。
CH3COO-+H+,当想稀醋酸中加入少量醋酸钠固体时,溶液中c(CH3COO-)增大,醋酸的电离平衡逆向移动,从而减小了醋酸的电离程度,正确;B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液中c(OH-)=(0.02 mol·L-1×2-0.02 mol·L-1)÷2=0.01mol/L,由于在室温下水的离子积常数是10-14,所以c(H+)=10-12mol/L,故溶液pH约为12,正确;C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,第一种溶液中氢离子的浓度是第二种溶液中氢离子浓度的10倍。由于溶液的浓度越大,其电离程度就越小,所以则c1>10c2,错误;D.pH=11的NaOH溶液的氢氧根离子的浓度与pH=3的醋酸溶液中氢离子的浓度相等。由于醋酸是弱酸,主要以电解质分子存在,在溶液中存在电离平衡,党二者等体积混合后,由于醋酸过量,溶液显酸性,滴入石蕊溶液时,溶液呈红色,正确。
考点:考查电解质溶液的有关知识。
【题型】选择题
【适用】较难
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(s) zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是
A.C的体积分数降低
B.x+y=z
C.平衡向正反应方向移动
D.x+y<z
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:填空题
(1)据报道,北京奥运会“祥云”火炬燃料为丙烷,悉尼奥运会火炬燃料为丁烷和丙烷混合气。标准状况下,1.0mol丙烷和丁烷的混合气和足量氧气混合完全燃烧后,恢复至原状态,混合气体的体积减小了70.0L,混合气体中丙烷和丁烷的体积比为______
(2)用一个甲基,一个乙基、一个—C3H7分别取代苯环上的氢原子,所得的三取代物有 种。
(3) 组成的混合物中碳的质量分数为 。
组成的混合物中碳的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南琼海嘉积中学高一下期末文科化学试卷(解析版) 题型:填空题
(1)对于反应2S02(g)+O2(g)=2SO3(g),当其他条件不变时,只改变一个反应条件。将生成SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3的速率 |
① | 降低温度 | |
② | 压缩体积 | |
③ | 使用催化剂 |
(2)用铜片、锌片和稀硫酸及若干其他器材组合成一个原电池.如图所示。回答下列问题:
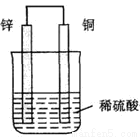
① 该原电池装置将_______(选填“化学能转化为电能”或“电能转化为化学能”);
② 此电池的负极是______,正极的电极反应方程式是________。
③ 该电池工作一段时间,将两个电极小心取出洗涤并晾干,经称量发现锌片比原来减少6.5g(锌的相对原子质量为:65)。请计算理论上导线中共通过了____mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com