
【题目】常温下下列溶液中确关微粒的物质的量浓度关系正确的是
A. 等物质的量浓度的CuSO4和(NH4)2SO4的混合溶液![]()
B. 0.2 mol/L NaHCO3溶液和0.1 mol/LNaOH溶液等体积相混合:![]()
C. pH=2的盐酸与pH=12的氨水等体积混合![]()
D. 0.1 mol/LCH3COONa溶液中通入HC1气体,至pH=7(溶液体积变化忽略不计):![]()
【答案】BD
【解析】A. 等物质的量浓度的CuSO4和(NH4)2SO4的混合溶液中由于铜离子和铵根离子水解,两种离子浓度减小,溶液呈酸性,则离子浓度大小关系为c(SO42-)>c(NH4+)>c(Cu2+)>c(H+),选项A错误;B、0.2 mol/L NaHCO3溶液和0.1 mol/LNaOH溶液等体积相混合所得溶液为碳酸钠和碳酸氢钠按1:1形成的溶液,根据物料守恒有:①2c(Na+)=3c(HCO3-)+3c(H2CO3)+3c(CO32-),根据电荷守恒有②c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),由①![]() 2+②
2+②![]() 得
得![]() ,选项B正确;C、pH=2的盐酸与pH=12的氨水等体积混合,氨水过量溶液呈碱性c(H+)<c(OH-),选项C错误;D、0.1 mol/LCH3COONa溶液中通入HC1气体,至pH=7,c(H+)=c(OH-),电荷守恒有c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CH3COO-),故有
,选项B正确;C、pH=2的盐酸与pH=12的氨水等体积混合,氨水过量溶液呈碱性c(H+)<c(OH-),选项C错误;D、0.1 mol/LCH3COONa溶液中通入HC1气体,至pH=7,c(H+)=c(OH-),电荷守恒有c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CH3COO-),故有![]() ,选项D正确。答案选BD。
,选项D正确。答案选BD。


科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的脱氧剂,其制备方法是向Na2CO3溶液中通入SO2,生成NaHSO3和CO2,一定条件下NaHSO3转化为Na2S2O5。
完成下列填空:
(1)碳原子的原子结构示意图是____________。氧原子核外能量不同的电子有_____种。CO2的电子式是_________________。
(2)从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。______________________
(3)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其化学方程式为_______________。
证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________。
(4)Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+H2O→Na2SO4+H2SO4,该反应中,氧化产物是_____;若反应中转移了0.04 mol的电子,有____g Na2S2O5参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据海水综合利用的工业流程图,判断下列说法不正确的是( )

A. 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
B. 在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 从能量转换角度看,氯碱工业电解饱和食盐水是一个将电能转化为化学能的过程
D. 从第④步到第⑤步的目的是富集Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.合成高分子材料包括塑料、合成纤维、合成橡胶、黏合剂、涂料等
B.用木材等经过加工制成的黏胶纤维属于合成纤维
C.棉花、羊毛和天然橡胶是有机高分子材料
D.合成橡胶的原料是煤、石油、天然气和农副产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,硫酸的用量被视为一个国家工业发达水平的一种标志。反应2SO2+O2![]() 2SO3是工业制取硫酸的主要反应之一,下列说法不正确的是( )
2SO3是工业制取硫酸的主要反应之一,下列说法不正确的是( )
A. 该反应为可逆反应,在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B. 达到平衡后,反应就停止了,正、逆反应速率相等且都为零
C. 在利用上述反应生产三氧化硫时,要考虑适当增大化学反应速率
D. 在利用上述反应生产三氧化硫时,要考虑使尽可能多的二氧化硫转化为三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化锶(SrO2·2H2O)晶体是一种白色粉末,微溶于水,常用作焰火的引火剂。制备流程如下:

反应原理![]() 该反应放热.
该反应放热.
(1)选择不同浓度的双氧水在反应器中反应,测得相同时间H2O2的利用率随浓度的变化关系如右图所示。5%的H2O2比20%的H2O2利用率低的原因是____。
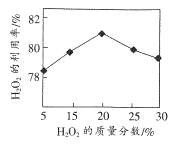
(2)SrO2.2H2O遇CO2会反应变质,反应的化学方程式为___。
(3)25℃时,将Sr(NO3)2溶液滴加到含有F一、CO32-的溶液中,当混合溶液中c(Sr2+)= 0.0010 mol/L时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-):c(CO32-)=__。
(4)准确称取1.8000 g SrO2·2H2O样品置于锥形瓶中,加入适量的盐酸使之充分转化为H2O2,再加入足量KI摇匀后置于暗处,充分反应后,加入少量淀粉试液,用1.0000 moI/L Na2S2O3标准溶液滴定到蓝色恰好消失时,共消耗标准溶液20.00 mL,计算SrO2·2H2O样品的纯度,写出计算过程__________。(已知:Ksp(SrF2)=4.0×10-9,Ksp(SrCO3)=5.0×10-9)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为满足不同的需要,人们应用原电池原理制作了多种电池。
(1)有人以化学反应2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则该原电池负极的电极反应为___________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,其反应的离子方程式为________________;若将此反应设计或原电池,则负极所用电极材料为___________,正极反应为_________________。
(3)美国阿波罗宇宙飞船上使用了一种新型发电装置—氢氧燃料电池,其构造如图所示,其中A、B两个电极均由多孔的碳炔组成,该电池的正极反应式为_________________,若该电池工作时溶液中增加1molH2O,则理论上电路中通过电子的物质的量为_______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com