
【题目】不能正确表示下列变化的离子方程式的是
A.MnO2与浓盐酸加热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.FeCl2溶液在空气中变质:12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓
C.NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
D.R-NH2电离:R-NH2+H2O![]() R-NH3++OH-
R-NH3++OH-
【答案】C
【解析】
因为电离常数:碳酸K1=4.4×10-7、K2=4.7×10-11;次氯酸K=2.9×10-8,因此酸性强弱为H2CO3>HClO>HCO3-,根据强酸制弱酸原理,离子方程式为:ClO- +CO2+ H2O=HClO + HCO3-,不发生 HCO3- + ClO-=HClO + CO32-,因为HClO的酸性强于HCO3-,不论少量或过量都一样。
A.MnO2与浓盐酸加热反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,A正确;
Mn2++Cl2↑+2H2O,A正确;
B.FeCl2溶液在空气中变质发生的离子方程式为:12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓,B正确;
C.NaClO溶液中通入少量CO2,根据强酸制弱酸的原理,只发生离子方程式:ClO- +CO2+ H2O=HClO + HCO3-,不发生 HCO3- + ClO-=HClO + CO32-,不会生成CO32-,C错误;
D.R-NH2电离离子方程式为:R-NH2+H2O![]() R-NH3++OH-,D正确;答案选C。
R-NH3++OH-,D正确;答案选C。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
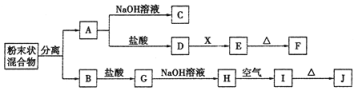
(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类应用较早, 当前应用量最大的金属元素,下列有关铁及其化合物的有关说法中不正确的是( )
A.磁铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe3O4和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入足量铁粉后过滤
D.Fe3与KSCN 溶液产生红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
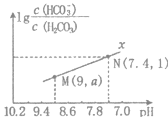
A.图中a=2.6
B.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-6.4
H2CO3+OH-的Kh=1.0×10-6.4
C.M点溶液中:![]()
D.若要表示题目条件下pH与lg![]() 的变化关系.则曲线应该在平行于曲线
的变化关系.则曲线应该在平行于曲线![]() 的下方
的下方
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】层状复合金属氢氧化物(简称“层状氢氧化物”),主体层板由二元(或多元)金属氢氧化物层构成,层间阴离子可以被其他阴离子取代,因此可以作为离子交换剂,在材料、化工、医药和环境保护等方面有着广泛的用途。镁铝碳酸根型水滑石是人们最早发现的层状氢氧化物。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最小的是___________(填标号)。
A. B.
B. C.
C.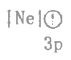 D.
D.
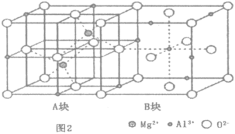
(2)一种水滑石的化学式为Mg4Al2(OH)12CO3H2O.其层板结构如图1。CO32-中碳的杂化类型是____。在图中最小的一个二维菱形晶胞(以图中Al为顶点)中含有___________个Al3+。每个镁氧八面体周围有_______________个相邻铝氧八面体和_______________个相邻镁氧八面体。
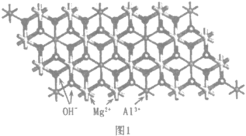
(3)水滑石中氢氧化物层的OH-和层间阴离子间的主要作用力为_______________,水滑石作为离子交换剂,去除水体中阴离子去除效果依次为:PO43->CrO42->NO3-,其原因是___________
(4)当加热到一定温度时,水滑石类化合物会发生分解,部分产物转化为尖晶石结构的MgxAlyOz,晶体结构如图2所示,它的化学式为___________;A块、B块均为边长为apm的立方体,设阿伏加德罗常数为NA,则最近的两个Al离子之间的距离为___________pm,密度为___________gcm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据你所学习的元素周期律和周期表知识回答下列相关问题:
(1)现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质是一种淡黄色固体,是黑火药成分之一 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(i)元素Y的氢化物的电子式为____,其水溶液呈碱性的原因是(用电离方程式表示):____;
(ii)元素Z与元素T相比,非金属性较强的是___(填元素符号);
(iii)探寻物质的性质差异性是学习的重要方法之一,T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是___(填化学式)。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),把与下面元素有关的性质相符的曲线标号填入相应的空格中:

(i)IIA族元素的最外层电子数(填字母)____;
(ii)第三周期元素的最高化合价(填字母)____;
(iii)N3、O2、F、Na、Mg2、Al3的离子半径(填字母)___。
(3)周期表中某些元素化合物的易燃性、毒性变化有一定规律性,例如:
(i)氢化物的易燃性:第二周期___>__>H2O>HF,第三周期SiH4>PH3>___>___(填化学式);
(ii)化合物的毒性:PH3>NH3,H2S___H2O,CS2_CO2(选填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了讲授“氯气的性质和用途”,一老师以二氧化锰和浓盐酸为主要原料制取氯气,并设计了如图所示装置(其中A是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行教学。

试回答下列问题:
(1)乙和丙中的现象分别是 ____________________、____________________;由上述现象可得出结论:_____________________(写化学式)具有漂白作用;
(2)分离丁中液体的方法是 _______;
(3)圆底烧瓶内发生反应的化学方程式为__________________________________;
(4)分液漏斗与烧瓶连接橡皮管的目的是 __________________________________;
(5)己烧杯中反应的离子方程式为:________________________________________;
(6)将产生的Cl2通入FeCl2溶液中得到含有FeCl2和FeCl3的混合物,实验测得混合物中n(Fe元素)∶n(Cl元素)=1:2.4,则该溶液中Fe2+和Fe3+的物质的量浓度之比约为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,
其中反应条件及部分产物均已略去,则下列有关说法正确的是
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,最后有白色沉淀产生
D.工业上,B转化为D的反应条件为加热、使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可快速氧化 SO2。下列说法错误的是:
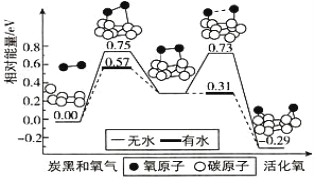
A.每活化一个氧分子放出 0.29 eV 能量
B.水可使氧分子活化反应的活化能降低 0.18 eV
C.氧分子的活化是氧氧共价键的断裂与碳氧共价键的生成过程
D.无水条件下该过程的活化能为 1.04 eV
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com