
����Ŀ��д�����и��л���Ľṹ��ʽ��
��1��ij��1mol��2mol HCl��ȫ�ӳɣ����ɵ��ȴ�������������4mol������Ӧ��������Ľṹ��ʽΪ________________________________��
��2��ij����A�������ܶ�����ͬ״���������ܶȵ�64�������ⶨ��֪A�����й���6��������A��������ϩ���������ӳɵIJ��A�Ľṹ��ʽΪ____________________________��
��3��0.2 molij��A����������ȫȼ�պ�����CO2��H2O��1.2 mol��
������A����ʹ��ˮ��ɫ������һ��������������������ȡ����Ӧ����һ��ȡ����ֻ��һ�֣�����A�Ľṹ��ʽΪ__________________________��
�� ����A��ʹ��ˮ��ɫ����A�ڴ��������¿�����H2 �����ӳɷ�Ӧ����ӳɲ�������к���4�����������A�ķ��������е�̼ԭ�Ӳ����ܴ���ͬһƽ���ϣ�����A���ܵĽṹ��ʽΪ________________________________��_______________________________��
���𰸡� CH![]() CH (CH3)3CCH2C(CH3)3
CH (CH3)3CCH2C(CH3)3 ![]() CH2��CHC(CH3)3 CH2��C(CH3)CH(CH3)2
CH2��CHC(CH3)3 CH2��C(CH3)CH(CH3)2
��������(1)��1mol��2molHCl��ȫ�ӳɣ����ɵ��ȴ�����������4molCl2��Ӧ����A�к�2��H���Ҵ���̼̼�����������Ľṹ��ʽΪCH��CH���ʴ�Ϊ��CH��CH��
(2)��������ܶ�֮�ȵ���Ħ������֮�ȣ�����A������Ħ������Ϊ2g/mol��64=128g/mol����12n+2n+2=128�����n=9����������A�ķ���ʽΪC9H20��A��������������ϩ���ӳɵIJ��˵��A������C�䲻���ܴ���C=C����Cֻ�ܹ���4��������˵õ�A�Ľṹ��ʽ��(CH3)3CCH2C(CH3)3���ʴ�Ϊ��(CH3)3CCH2C(CH3)3��
(3)n(��)��n(C)��n(H)=n(��)��n(CO2)��2n(H2O)=0.1mol��0.6mol��0.6mol��2=1��6��12����1�������к���6��Cԭ�ӡ�12��Hԭ�ӣ��ʸ����ķ���ʽΪC6H12��
������A����ʹ��ˮ��ɫ����AΪ������������һ��������������������ȡ����Ӧ����һ��ȡ����ֻ��һ�֣���Ϊ�����飺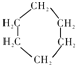 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
����A�ڴ��������£���H2�ӳɣ���ӳɲ��ᆳ�ⶨ�����к���4������˵�����к���C=C�����У����� 4�������� 3�֣���̼�ܽṹΪ(�٢ڢ۴�Ϊ˫�����ܳ��ֵ�λ��)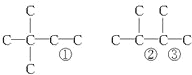 ����A�����еĽṹ��ʽΪCH2=CHC(CH3)3��CH2=C(CH3)CH(CH3)2�ȣ��ʴ�Ϊ��CH2=CHC(CH3)3��CH2=C(CH3)CH(CH3)2��
����A�����еĽṹ��ʽΪCH2=CHC(CH3)3��CH2=C(CH3)CH(CH3)2�ȣ��ʴ�Ϊ��CH2=CHC(CH3)3��CH2=C(CH3)CH(CH3)2��


 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��W��ԭ��������������X��Wͬ���壻Y��Zͬ���ڣ�X��Y��Z����Ԫ���γ�һ�ֻ�����M��25 ��ʱ��0.1 molL-1��M��Һ��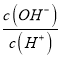 =1.0��10-12������˵����ȷ����
=1.0��10-12������˵����ȷ����
A. �����Ӱ뾶��Y<Z<W
B. X�քe��Z��W�γɵĻ������У�������ѧ��������ͬ
C. X��Y�γɵ��������ĵ���ʽΪ![]()
D. Z�քe��X��W�����γɾ���Ư���ԵĻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���������������������� Fe2O3�� Fe3O4�� Al2O3�� CaO�� SiO2 �ȣ�Ϊԭ����ȡ������ Fe2O3��Ҫ��>99.2%�� CaO ����<0.01%�����乤����������(�������Լ����Թ���)��

��֪��������������� pH ���±���ʾ
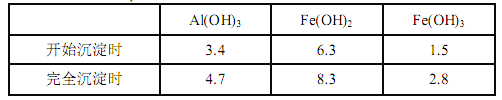
��1������ A ����Ҫ�ɷ���__________��
��2���ڹ��̢��пɹ۲쵽�����������ݣ���Һ��ɫ������dz���ܽ���ʵ����������ӷ���ʽ��__________��
��3���ڹ��̢��У����������Һ A ϡ�Ͳ�ͬ������,����������Ĺ�������,�ó� Fe3+Ũ�ȡ���ԭ�ʺͷ�Ӧʱ��Ĺ�ϵ��ͼ��ʾ���������ʵ����˵����������ѡ��ϡ�ͺ�c(Fe3+)Ϊ 1.60mol/L ���ҵ�������______��
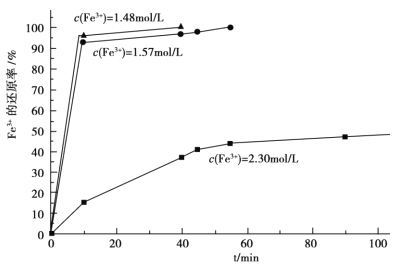
��4���ڹ��̢��У�����������ͬ�����£���ѡ���˲�ͬ���Ƽ�����ʵ�飬ʵ�����ݼ��±�������֪����Һ B �иƵĺ����� CaO ��Ϊ 290��310mg/L��
���Ƽ� | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
����/g | 2 | 2 | 2 | 5 | 2 |
ʣ��CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
����ʵ������ ѡ�����˵ij��Ƽ����õ����� C ����Ҫ�ɷ���__________��
��5���ڹ��̢��У���Ӧ�¶���Ҫ������ 35�����£����˹��ߣ�����ܵ�ԭ����__________��
��6���ڹ��̢��У���Ӧ�Ļ�ѧ����ʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����ƿ��װ�и��������A����ͷ�ι���ʢ��Һ��B������ѹ��ͷ�ιܣ�ʹҺ��B����ƿ�У���һ����ɼ�С����C�������������A��Һ��B����ܵ��� ( )

A. A��Cl2��B�DZ���ʳ��ˮ
B. A��CO2��B��NaHCO3������Һ
C. A��NO��B��ˮ
D. A��SO2��B���ռ���Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��FeCl3��Һ�м�������,��Һ��___ɫ��Ϊ___ɫ���÷�Ӧ�����ӷ���ʽΪ______��
��2����ȥFeCl3��Һ�л��е�FeCl2������Һ��ͨ��______�����������ƣ����÷�Ӧ�����ӷ���ʽΪ______��
��3����Fe3O4 ��4CO![]() 3Fe��4CO 2�ķ�Ӧ�У�_____������������������Ԫ��Ϊ____������������________������11.6g Fe3O4�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ__________��
3Fe��4CO 2�ķ�Ӧ�У�_____������������������Ԫ��Ϊ____������������________������11.6g Fe3O4�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. ���ܵ�������Ƚ�ʱ��KSPС�ģ��ܽ��һ��С
B. KSP��Сȡ�������ܵ���ʵ��ܽ�ȣ���������Ũ�ȸı�ʱKSP�ᷢ���仯
C. ��ν������ȫ�����ó���������Һ��ijһ������ȫ��ȥ
D. �¶�һ��������Һ��Ag+��Cl��Ũ�ȵij˻���KSPʱ����ҺΪAgCl�ı�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ģ�ҵƯ��Һ����Ч�ɷ�ΪNaClO���ѳ���ˮ�а�����NH3�����������£�

���з�����ȷ����
A. ���в�������ķ������ƴ���ˮ
B. ������������Ҫ�缫��Ӧ��4OH- - 4e- = 2H2O + O2��
C. �����Ʊ�Ư��Һ�ķ�Ӧ��Cl2 + OH- = Cl- + HClO
D. �ڡ��ۡ����о�������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ⱥ����ܱ�������ͨ��N2��H2����һ��������ʹ��ӦN2(g)+3H2(g)![]() 2NH3(g) ��H��0�ﵽƽ�⣬n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ�������й�������ȷ����( )
2NH3(g) ��H��0�ﵽƽ�⣬n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ�������й�������ȷ����( )
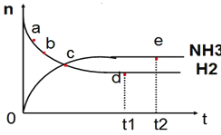
A��c���ʾNH3����������NH3�ֽ�������ͬ
B��c���e��ʱ��Ӧ��ƽ�ⳣ����ͬ
C��N2��ת���ʣ�b��a
D��d��ʱ��n(N2):n(H2):n(NH3)=1:3:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ķ�Ӧ·��������Ϣ��ա�
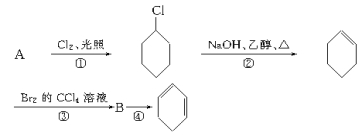
��1��A�Ľṹ��ʽ�� �������� ��
��2���ٵķ�Ӧ������ ���۵ķ�Ӧ������ ��
��3����Ӧ�� �Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com