
【题目】以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中不正确的是

A. 该生产工艺中Br2被循环利用
B. 在电解过程中,电解槽阴极附近溶液的pH变大
C. 原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+
D. 该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO4
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硫粉在过量的氧气中燃烧可以生成SO3
B.可以用澄清石灰水鉴别CO2和SO2
C.将少量CO2通入BaCl2溶液能生成白色沉淀
D.不能用排水法收集SO2、NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是重要的矿藏,以黄铜矿为原料生产碱式氯化铜和铁红(氧化铁)颜料的工艺流程如图所示。

(1)反应Ⅰ的离子方程式为_____________,该反应的氧化剂是________________。
(2)反应Ⅱ的离子方程式为_________________________。
(3)反应Ⅵ是在45~50℃的条件下进行的,写出该反应的化学方程式:__________________。
(4)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O,为测定某碱式氯化铜的组成,某实验小组进行下列实验:
①称取样品9.30g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得到AgCl固体1.435g;
③另取25.00mL溶液A,调节pH为4~5,用浓度为0.40mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液50.00mL。通过计算确定该样品的化学式为___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中常用氧化浓盐酸的方法制取氯气,实验装置如图所示:
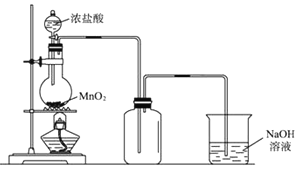
(1)写出制备氯气的离子方程式: ______ ;
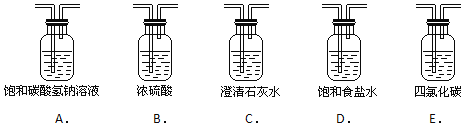
(2)为了得到纯净、干燥的氯气,此装置还需增加净化装置,请根据气体的流动方向,依次按顺序选择所用的装置,正确的选项是 ______ ;
(3)如果将过量二氧化锰与20mL12mol/L的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,其主要原因有:① ______ ;② ______ .
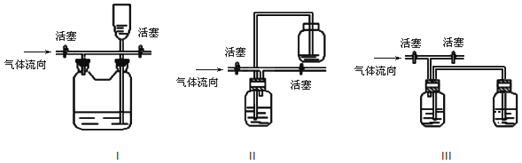
(4)多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置 ______ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 氯化钠可用于配制生理盐水 B. 二氧化硅可用于制造玻璃
C. 海水中的钠元素以单质存在 D. 氧化镁(熔点2 800 ℃)是优良的耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态K原子核外电子排布简写式为___________。 K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是_________,各元素的第一电离能由大到小的顺序为_________。
(2)(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为_______。KCN与盐酸作用可生成HCN,HCN的中心原子的杂化轨道类型为_________。
(3)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为为376 K,其固体属于_____晶体。
(4)下图是金属单质常见的两种堆积方式的晶胞模型。

①铁采纳的是a堆积方式.铁原子的配位数为_____,该晶体中原子总体积占晶体体积的比值为____(用含π的最简代数式表示)。
②常见的金属铝采纳的是b堆积方式,铝原子的半径为r pm,则其晶体密度为_____g·cm-3(用含有r、NA的最简代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。p、q、r是由这些元素组成的二元化合物,常温常压下,p为无色无味气体,q为液态,r为淡黄色固体,s是气体单质。上述物质的转化关系如下图所示。下列说法错误的是

A. 原子半径:Z>Y>X
B. 最简单气态氢化物的稳定性:Y>X
C. m、n、r都含有离子键和共价键
D. m、n、t都能破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周环反应是一类同时成键与断键的反应,经典的周环反应有Diels-Alder反应![]() 、电环化反应(electrocyclicreaction):
、电环化反应(electrocyclicreaction): ![]() 等。
等。
已知:  ,其中R1、R2、R3为烷基。
,其中R1、R2、R3为烷基。
现有一种内酯I(含两个五元环)的合成路线如下(A~I均表示一种有机化合物):

回答下列问题:
(1)化合物A中含有的官能团名称是_______,D的分子式为_______。
(2)由C生成D的反应类型为_______,A形成高聚物的结构简式为_______。
(3)写出F与足量银氨溶液反应的化学方程式_______ 。
(4)化合物H的系统命名为_______ 。
(5)化合物I的质谱表明其相对分子质量为142,I的核磁共振氢谱显示为2组峰,I的结构简式为_______ 。
(6)在化合物I的同分异构体中能同时符合下列条件的是_______ (填写结构简式)。
①具有酚结构;②仅有一种官能团;③具有4种氢原子
(7)2,5-二甲基四氢呋喃(![]() )是新的液态代用燃料,其具有比能量高、沸点高、可再生等优点。该有机物可由A先与H2发生加成反应等一系列步骤来制备,请写出合成路线______(其它试剂任选)。
)是新的液态代用燃料,其具有比能量高、沸点高、可再生等优点。该有机物可由A先与H2发生加成反应等一系列步骤来制备,请写出合成路线______(其它试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com