
| 1000ρω |
| M |
| V |
| Vm |
| 30g+50g |
| 100g+100g |
| 50%D+30%d |
| D+d |
| d |
| D+d |
| d |
| D+d |
| 1 |
| 2 |
| 50%D+30%d |
| D+d |
| 1000ρω |
| M |
| 1000A×98% |
| 98 |
| 1000a×49% |
| 98 |
| 1000a×49% |
| 98 |
| 22.4L |
| 22.4L/mol |
|


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、中子数为20的氯原子:
| ||||
| B、硫酸的电离方程式:H2SO4=H22++SO42- | ||||
| C、漂白粉的有效成分:CaCl2 | ||||
D、铝离子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
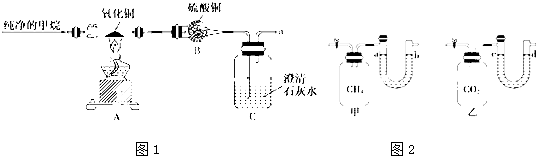
查看答案和解析>>
科目:高中化学 来源: 题型:
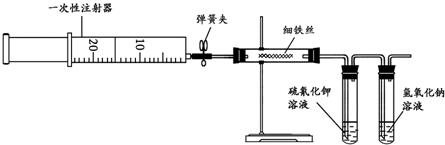
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、283kJ |
| B、110kJ |
| C、196.5kJ |
| D、56.6kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| KMnO4酸性溶液的浓度/mol?L-1[学|科| | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
| 实验编号 | 20℃下,试管中所加试剂及其用量/mL | 20℃下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 4 | 4.0 | 1.0 | 3.0 | 2.0 | 4.0 |
| 5 | 2.5 | 2.5 | 3.0 | 2.0 | 4.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com