
【题目】2017年采用中国自主知识产权的全球首套煤基乙醇工业化项目投产成功。某地煤制乙醇的过程表示如下。
(1)Cu(NO3)2是制备“催化剂X”的重要试剂。

① 气体A是_______。
② 实验室用Cu(NO3)2固体配制溶液,常加入少量稀HNO3。运用化学平衡原理简述HNO3的作用_______。
③ NaClO溶液吸收气体A的离子方程式是_______。
(2)过程a包括以下3个主要反应:
Ⅰ.CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) ΔH1
C2H5OH(g)+CH3OH(g) ΔH1
Ⅱ.CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5 (g)+CH3OH(g) ΔH2
CH3COOC2H5 (g)+CH3OH(g) ΔH2
Ⅲ.CH3COOCH3(g)+H2(g)![]() CH3CHO(g)+CH3OH(g) ΔH3
CH3CHO(g)+CH3OH(g) ΔH3
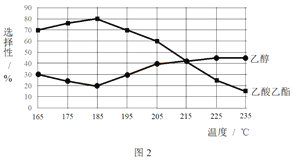
相同时间内,测得CH3COOCH3转化率、乙醇和乙酸乙酯的选择性(如乙醇选择性= ![]() )如下图所示。
)如下图所示。
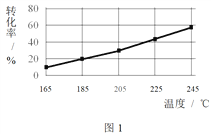
① 已知:ΔH1 < 0。随温度降低,反应Ⅰ化学平衡常数的变化趋势是_______。
② 下列说法不合理的是________。
A.温度可影响反应的选择性
B.225℃~235℃,反应Ⅰ处于平衡状态
C.增大H2的浓度,可以提高CH3COOCH3的转化率
③ 为防止“反应Ⅲ”发生,反应温度应控制的范围是_______。
④ 在185℃下,CH3COOCH3起始物质的量为5 mol,生成乙醇的物质的量是____。
【答案】 NO Cu2+ + 2H2O Cu(OH)2 + 2H+ ,加入硝酸,使c(H+)增大,平衡逆向移动,从而抑制 Cu(NO3)2的水解 ![]() 增大 B < 205℃ 0.2 mol
增大 B < 205℃ 0.2 mol
【解析】(1)①铜与稀硝酸反应生成硝酸铜和一氧化氮,气体A为NO,故答案为:NO;
② 实验室用Cu(NO3)2固体配制溶液,常加入少量稀HNO3,Cu2+ + 2H2O Cu(OH)2 + 2H+ ,加入硝酸,使c(H+)增大,平衡逆向移动,从而抑制 Cu(NO3)2的水解,故答案为:Cu2+ + 2H2O Cu(OH)2 + 2H+ ,加入硝酸,使c(H+)增大,平衡逆向移动,从而抑制 Cu(NO3)2的水解;
③ NaClO溶液吸收气体NO,根据图示,次氯酸钠将NO氧化为硝酸根离子,反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)① 反应Ⅰ的ΔH1 < 0,为放热反应,温度降低,平衡正向移动,化学平衡常数增大,故答案为:增大;
② A.根据图像,温度小于185℃时,随温度升高,乙醇的选择性降低,乙酸乙酯的选择性增大,温度高于185℃时,随温度升高,乙醇的选择性增大,乙酸乙酯的选择性降低,温度影响反应的选择性,故A正确;B.225℃~235℃,乙醇和乙酸乙酯的选择性相同,但不表示反应Ⅰ处于平衡状态,故B错误;C.根据反应I,增大H2的浓度,平衡正向移动,CH3COOCH3的转化率提高,故C正确;故选B;
③ 根据图2,温度超过205℃时,乙醇的选择性变化不大,但乙酸乙酯的选择性较大,如果温度升高,乙酸乙酯的选择性大幅度减小,不利于反应生成乙醇,为防止“反应Ⅲ”发生,应控制温度低于205℃,故答案为:< 205℃;
④ 在185℃下,乙醇选择性为20%,CH3COOCH3的转化率为20%,则5 molCH3COOCH3反应生成乙醇的物质的量=5mol×20%×20%=0.2mol,故答案为:0.2 mol。


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:
【题目】中学化学中的一些常见物质有下图转化关系(部分产物未给出)。其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属。

回答下列问题。
(1)F的电子式为 。
(2)G的化学式为 。
(3)写出反应①的化学方程式 。
(4)写出反应②的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶质的质量分数 | 溶液的密度/gcm-3 | |
硫酸 | c1 | w1 | ρ1 |
氨水 | c2 | w2 | ρ2 |

(1)表中硫酸的质量分数w1为_____(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为_______mol·L-1,质量分数_______w1/2(填“大于”、“小于”或“等于”,下同)。
(3)质量分数为w2的氨水与w2/5的氨水等质量混合,所得溶液的密度_____ρ2 gcm-3。
(4)标况下700体积的氨气溶解于1体积水中形成氨水饱和溶液,溶液的密度为d g/cm3,则该溶液的物质的量浓度为________(用含有d的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,按要求作答:

(1)装置中c、d、e的名称分别为____________、____________、____________。
(2)分离下列物质,需要在哪套装置中进行?
Ⅰ.干燥H2,可采用_______(填装置序号)装置。
Ⅱ. 分离碘水中的碘应先选择装置_____(填装置序号)进行_______和_______操作。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq) + OH—(aq)![]() F—(aq) + H2O(l) △H=-67.7 kJ/mol
F—(aq) + H2O(l) △H=-67.7 kJ/mol
H+(aq) + OH—(aq)![]() H2O(l) △H=-57.3kJ/mol
H2O(l) △H=-57.3kJ/mol
在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是
A. 当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发)
B. 水电离的热化学方程式为:H2O(1)![]() H+(aq)+OH—(aq);△H= +57.3kJ/mol
H+(aq)+OH—(aq);△H= +57.3kJ/mol
C. 当c > 0.1时,一定不存在:c(Na+) = c(F—)
D. 若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓是一种低熔点高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业;镓(Ga)与铝位于同一主族,金属镓的熔点是29.8℃,沸点是2403℃。
(1)工业上利用Ga(l)与NH3(g)在1000℃高温下合成半导体固体材料氮化镓(GaN),同时生成氢气,每生成lmol H2时放出10.3 kJ热量。写出该反应的热化学方程式__________________。
(2)在密闭容器中,充入一定量的Ga与NH3发生反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。
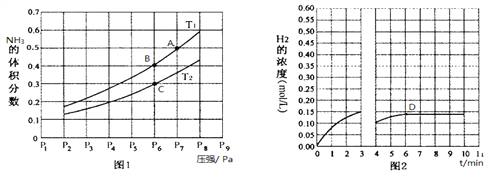
① 图1中A点和C点化学平衡常数的大小关系是:KA_____KC,(填“<”、“=”或“>”),理由是__________________________________________________。
② 该反应在T1和P6条件下至3min时达到平衡,此时改变条件并于D点处重新达到平衡,H2的浓度随反应时间的变化趋势如图2所示(3~4 min的浓度变化未表示出来),则改变的条件为__________(仅改变温度或压强中的一种)。
(3)若用压强平衡常数Kp表示,此时B点对应的Kp=__________(用含P6的式子表示)(Kp为压强平衡常数,用平衡分压代替平衡浓度计算,气体平衡分压=总压×气体体积分数)
(4)电解精炼法提纯镓的具体原理如下:以粗镓(含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH溶液为电解质。在电流作用下使粗镓溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+。电解精炼镓时阳极泥的成分是_________。
②阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,写出GaO2-在阴极放电的电极反应式是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com