
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是()
A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B. 电池放电时,负极反应为Fe+2OH﹣﹣2e﹣=Fe(OH)2
C. 电池充电过程中,阴极附近溶液的pH降低
D. 电池充电时,阳极反应为2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O
考点: 原电池和电解池的工作原理;电极反应和电池反应方程式.
分析: 根据电池的总反应:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,最终生成Fe(OH)2,Ni2O3作正极,发生还原反应,为氧化剂,得电子,最终生成Ni(OH)2,电池放电时,负极反应为Fe+2OH﹣﹣2e﹣=Fe(OH)2,则充电时,阴极发生Fe(OH)2+2e﹣=Fe+2OH﹣,阴极附近溶液的pH升高,电池充电时,阳极发生2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O.
解答: 解:A、反应后产物有氢氧化物,可得电解液为碱性溶液,由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,即正极为Ni2O3、负极为Fe,故A正确;
B、根据总反应Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,碱性电解质中最终生成Fe(OH)2,负极反应为:Fe+2OH﹣﹣2e﹣=Fe(OH)2,故B正确;
C、充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为:Fe+2OH﹣﹣2e﹣=Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e﹣=Fe+2OH﹣,因此电池充电过程中阴极附近溶液的pH会升高,故C错误;
D、充电时,阴极发生Fe(OH)2+2e﹣=Fe+2OH﹣,阳极发生2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O,故D正确.
故选C.
点评: 本题考查二次电池的工作原理,涉及到原电池和电解池的有关知识,做题时注意根据总反应从氧化还原的角度判断化合价的变化,以得出电池的正负极以及所发生的反应.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 乙醇分子中的氢原子均可被金属钠置换 |
|
| B. | 烃分子中的氢原子被羟基取代后的衍生物都属于醇 |
|
| C. | 甲醇是最简单的醇,它不能发生消去反应生成烯烃 |
|
| D. | 某一元醇在浓硫酸存在下加热到170℃可以生成丙烯,该一元醇一定是1﹣丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、AlO2﹣、CO32﹣、SiO32﹣、Cl﹣中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成.
②另取少量原溶液,逐滴加入5mL0.2mol•L﹣1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失.
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43g.
下列说法中正确的是( )
A. 该溶液中一定不含Ba2+、Mg2+、A13+、SiO32﹣、Cl﹣
B. 该溶液中一定含有K+、AlO2﹣、CO32﹣、Cl﹣
C. 该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片)
D. 可能含有Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、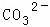 、
、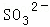 、
、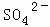 、Cl﹣、
、Cl﹣、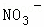 中的一种或几种,取该溶液进行迂续实验,实验内容如下:
中的一种或几种,取该溶液进行迂续实验,实验内容如下:
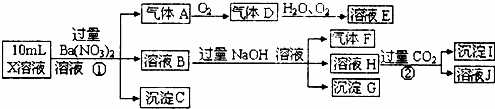
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ,不能确定是否含有的离子是,若要确定其中阳离子的存在,最可靠的化学方法是 .
沉淀G的化学式为.
(3)写出有关离子方程式:
步骤①中生成A.
步骤②生成沉淀I.
(4)假设测定A、F、I均为0.01mol,10mLX溶液中n(H+)=0.04mol,而沉淀C物质的量0.07mol,能说明(1)中不能确定的阴离子存在的理由是. .
查看答案和解析>>
科目:高中化学 来源: 题型:
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图.下列结论正确的是()
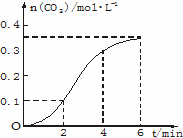
A. 反应开始4 min内温度对反应速率的影响比浓度小
B. 反应4 min后平均反应速率最小
C. 反应开始2 min内平均反应速率最大
D. 反应在第2 min到第4 min间生成CO2的平均反应速率为 v(CO2)=0.1 mo1•(L•min)﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,下列叙述正确的是()
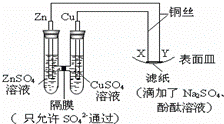
A. Y为阴极,发生还原反应 B. X为正极,发生氧化反应
C. Y与滤纸接触处有氧气生成 D. X与滤纸接触处变红
查看答案和解析>>
科目:高中化学 来源: 题型:
取3.4 g只含羟基、不含其他官能团的液态饱和多元醇,置于5.00 L氧气中,经点燃,醇完全燃烧。反应后气体体积减少了0.56 L。将气体经CaO吸收,体积又减少2.80 L(所取体积均在标准状况下测定)。
(1)求出该醇中C、H、O的原子数之比。
(2)由以上比值能否确定该醇的分子式,为什么?
(3)如果将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,试写出该饱和多元醇的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
要除去FeCl3溶液中混有少量的FeCl2,可加入 ,反应的离子方程式为 ﹣;要除去FeCl2溶液中的少量FeCl3,可加入铁粉,离子方程式为 +;要除去FeCl2溶液中的少量CuCl2,可加入 ,离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com