
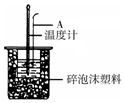
 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
分析 (1)根据稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量书写热化学方程式;
(2)根据仪器的结构可知,仪器A是环形玻璃搅拌棒;如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,酸和碱之间因为中和反应而导致的热量损失;
(3)先求出三次反应的温度差,根据公式Q=cm△T来求出生成0.05mol的水放出热量,最后根据中和热的概念求出反应热;
(4)根据实验的关键是保温,如果装置有能量散失,则会导致结果偏低,根据实验中用到的试剂以及实验操作知识来判断.
解答 解:(1)稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,稀硫酸和氢氧化钠稀溶液分别是强酸、强碱,则反应的热化学方程式为NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)仪器A是环形玻璃搅拌棒;如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,酸和碱之间因为中和反应而导致的热量损失,求得的中和热数值将会减小,但反应热△H>-57.3KJ/mol;
故答案为:环形玻璃搅拌棒;>;
(3)第1次实验盐酸和NaOH溶液起始平均温度为20.25℃,反应后的最高温度为23.7℃,反应前后温度差为:3.45℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.40℃,反应后的最高温度为23.8℃,反应前后温度差为:3.40℃;
第3次实验盐酸和NaOH溶液起始平均温度为21.55℃,反应后的最高温度为24.9℃,反应前后温度差为:3.35℃;
三组数据都有效,温度差平均值为3.40℃,50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液的质量和为m=100mL×1g/mL=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.40℃=1421.2J=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为$\frac{1.4212kJ×1mol}{0.025mol}$=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol;
故答案为:-56.8 kJ•mol-1;
(4)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小,故A正确;
B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,实验测得中和热的数值偏小,故B正确;
C、做本实验的室温和反应热的数据之间无关,故C错误;
D、将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于氨水是弱碱,碱的电离是吸热的过程,所以导致实验测得中和热的数值偏小,故D正确;
E、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,算过量,可以保证碱全反应,会使得中和和热的测定数据偏高,故E错误;
F、大烧杯的盖板中间小孔太大,会导致一部分能量散失,所以测的数值降低,故F正确.
故答案为:ABDF.
点评 本题考查中和热的测定与计算,实验误差分析,题目难度中等,侧重于考查学生的实验能力和计算能力.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ•mol-1 | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ•mol-1 | |
| C. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-1 076.7 kJ•mol-1 | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 076.7 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为18的氧核素:${\;}_8^{18}$O | B. | 锂离子的结构示意图: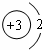 | ||
| C. | 硝基苯的结构简式: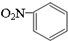 | D. | 四氯化碳的电子式: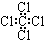 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含有FeBr2的溶液中通入过量Cl2充分反应:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| B. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 磁性氧化铁溶于稀硝酸:3 Fe2++4H ++NO3-═3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2 SO42-═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钙的摩尔质量是74 g•mol-1 | B. | 阿伏加德罗常数是6.02×1023 | ||
| C. | 1 mol H | D. | 1 mol CO约含有6.02×1023个CO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
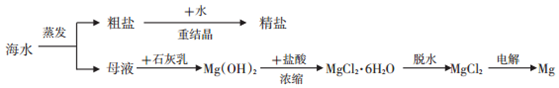
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com