
| A. | 6.02×1023是阿伏加德罗常数的近似值 | |
| B. | 阿伏加德常数个微粒的物质的量是1 mol | |
| C. | 1 mol 12C原子的质量为12 g | |
| D. | 硫酸的摩尔质量是98 g |
分析 A.阿伏加德罗常数的近似值为6.02×1023;
B.1mol任何物质都含有阿伏伽德罗常数个微粒;
C.12C原子的摩尔质量为12g/mol,则m=M×n;
D.摩尔质量的单位是g/mol.
解答 解:A.阿伏加德罗常数的近似值为6.02×1023,精确值为12g12C所含的碳原子数,故A正确;
B.阿伏加德常数个微粒的物质的量是1mol,故B正确;
C.1mol 12C原子的质量m=M×n=12g/mol×1mol=12g,故C正确;
D.硫酸的摩尔质量是98g/mol,故D错误;
故选:D.
点评 本题考查了阿伏伽德罗常数的应用,题目难度不大,熟悉阿伏伽德罗常数的意义和规定,明确物质的量、微粒个数、阿伏伽德罗常数之间的关系是解题关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
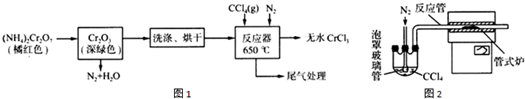
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中的氧气和二氧化碳通过光合作用与呼吸作用可以相互转化 | |
| B. | 实验室制氧气和二氧化碳都可通过分解反应制得 | |
| C. | 氧气和二氧化碳都可以用向上排空气法收集 | |
| D. | 一般情况下,氧气能支持燃烧,二氧化碳不能支持燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | A的初始浓 度/(mol•L-1) | B的初始浓 度/(mol•L-1) | 生成C的初始速 率/(mol•L-1•s-1) |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 1.0 | 2.0 | 4.8×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,I为具有磁性的黑色晶体,它们有如图所示的转化关系:
A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,I为具有磁性的黑色晶体,它们有如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 几种有机物的转化关系如图所示:已知流程中W、X、Z都不能与新制氢氧化铜悬浊液反应生成红色固体.X、Y重新组合生成的酯有( )
几种有机物的转化关系如图所示:已知流程中W、X、Z都不能与新制氢氧化铜悬浊液反应生成红色固体.X、Y重新组合生成的酯有( )| A. | 2种 | B. | 4种 | C. | 6种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 香蕉水主要用作喷漆的溶剂和稀释剂,其主要成分乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
香蕉水主要用作喷漆的溶剂和稀释剂,其主要成分乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
| 物质名称 | 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
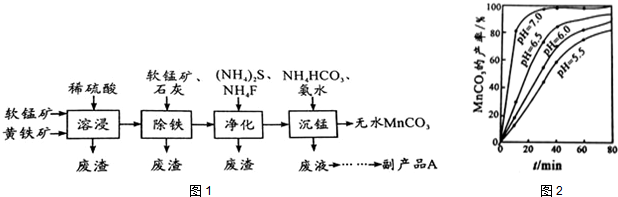
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com