
|
硫铁矿煅烧反应为:4FeS2+11O2 | |
A. |
将硫铁矿矿石磨成细粉,可以增大化学反应速率 |
B. |
改变压强不影响该反应的化学反应速率 |
C. |
升高温度可以增大化学反应速率 |
D. |
将生成的SO2分离出去可以增大化学反应速率 |
科目:高中化学 来源: 题型:阅读理解
 镁、铝、铁及其化合物在生产和生活中有广泛的应用.
镁、铝、铁及其化合物在生产和生活中有广泛的应用.| 实验序号 | I | II | III |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
| 0.12 |
| 28.12 |
| 0.12 |
| 28.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 我国由于硫磺主要依靠进口,所以目前主要以硫铁矿(FeS2)为原料制硫酸,俗称硫铁矿法.
我国由于硫磺主要依靠进口,所以目前主要以硫铁矿(FeS2)为原料制硫酸,俗称硫铁矿法.
| ||
| ||
| V2O5 |
| △ |
| V2O5 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
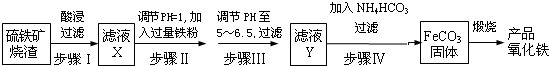
查看答案和解析>>
科目:高中化学 来源: 题型:
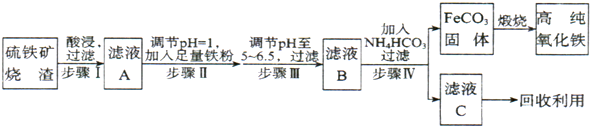
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com