
| A. | 氧气和二氧化硫 | B. | 盐酸和锌粒 | C. | 浓硝酸和铜屑 | D. | 醋酸和烧碱 |
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 试剂体积 V/mL | 显色时间 t/s | ||||
| K2S2O8溶液 | KI溶液 | 水 | Na2S2O3溶液 | 淀粉溶液 | ||
| ① | 10 | 10 | 0 | 4 | 1 | 26.8 |
| ② | 5 | 10 | 5 | 4 | 1 | 54.0 |
| ③ | 2.5 | 10 | V1 | 4 | 1 | 108.2 |
| ④ | 10 | 5 | 5 | 4 | 1 | 53.8 |
| ⑤ | 5 | 7.5 | 7.5 | 4 | V2 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气 | |
| B. | 雷雨天气时空气中能生成少量的氮氧化物 | |
| C. | 铵盐易溶于水,化学性质稳定,受热不易分解 | |
| D. | O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
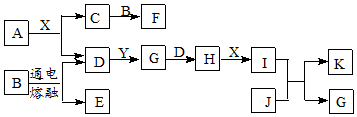
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H3=$\frac{1}{2}$(△H1+△H2) | B. | △H3=△H2-△H1 | C. | △H3=2(△H1+△H2) | D. | △H3=$\frac{1}{2}$(△H2-△H1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定物质的量浓度的溶液配制过程中,仰视定容,所得溶液的浓度偏大 | |
| B. | 相同体积和相同物质的量浓度的不同溶液里所含溶质的物质的量相同 | |
| C. | 溶液中溶质质量分数为w,密度为ρ g/cm3,溶质摩尔质量为M g/mol的溶液的物质的量浓度为$\frac{pw}{M}$mol/L | |
| D. | 10 mol/L的浓盐酸与H2O等质量混合所得混合液的浓度为5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质化学键的键能越大,说明物质本身所含的能量越高 | |
| B. | 同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件下的△H不同 | |
| C. | 有化学键断裂并伴随着能量变化的过程一定是化学反应 | |
| D. | 盖斯定律可以计算难于测量或不能测量的反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
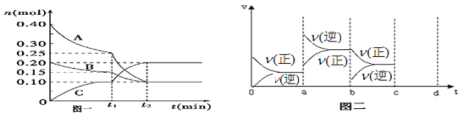
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com