
| A、在化学反应中,化学能只可以转化为热能 |
| B、合成氨工业中使用铁作催化剂以改变该反应的限度 |
| C、SO2和O2合成SO3的反应中,增大压强,该反应速率减小 |
| D、化学键的断裂和形成是化学反应中能量变化的主要原因 |


科目:高中化学 来源: 题型:
| ||
| A、增加Fe2O3的量 |
| B、保持容器体积不变,增加H2的输入量 |
| C、充入N2,保持容器内压强不变 |
| D、充入N2,保持容器内体积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1:2 | B、5:5:4 |
| C、1:1:1 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
| B、同pH时,三种溶液稀释相同倍数后,pH:a<b<c |
| C、同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c |
| D、同物质的量浓度的三种溶液的pH:a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| B、过量的SO2通入澄清石灰水中:Ca2++2OH-+SO2=CaSO3↓+H2O |
| C、盐酸与硅酸钠溶液混合:2H++SiO32-=H2SiO3↓ |
| D、硫酸铝溶液中加入到过量的烧碱中:Al3++3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2LN2含有的分子数为0.5NA |
| B、71gCl2 所含原子数为2 NA |
| C、2L 0.3mol/L K2SO4溶液中K+浓度为1.2mol/L |
| D、标况下,1molO2与22.4LH2O中所含分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
| 3 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
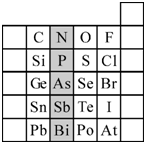 元素在周期表中的位置,反映元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com