
| A. | 水煤气 | B. | 焦炉煤气 | C. | 石油液化气 | D. | 高炉煤气 |
分析 某混合气体通过溴水(使其褪色),说明含有还原性气体,再通过灼热的氧化铜(使其黑色变红色),含有氢气或CO等气体,再通过无水硫酸铜白色粉末(使其变蓝色),说明含有氢气,再通过澄清的石灰水(石灰水由澄清变浑浊,再变澄清),说明生成二氧化碳,最后剩余气体在空气中点燃,火焰呈蓝色,说明含有甲烷等气体,以此解答该题.
解答 解:某混合气体通过溴水(使其褪色),说明含有还原性气体,再通过灼热的氧化铜(使其黑色变红色),含有氢气或CO等气体,再通过无水硫酸铜白色粉末(使其变蓝色),说明含有氢气,再通过澄清的石灰水(石灰水由澄清变浑浊,再变澄清),说明生成二氧化碳,最后剩余气体在空气中点燃,火焰呈蓝色,说明含有甲烷等气体,
A.水煤气的主要成分为CO和氢气,与溴水不反应,故A错误;
B.焦炉煤气含有CO、氢气、甲烷、硫化氢等气体,可与溴水、氧化铜反应生成水和二氧化碳,可使硫酸铜白色粉末变蓝色,使澄清石灰水变浑浊,甲烷点燃火焰呈蓝色,故B正确;
C.石油液化气为烷烃混合物,与溴水不反应,故C错误;
D.高炉煤气含有CO等气体,与溴水不反应,故D错误.
故选B.
点评 本题考查混合气体的推断,为高频考点,侧重于学生的分析能力的考查,题目难度不大,抓住题中反应的典型现象,掌握元素化合物的性质是做好此类题目的关键.


科目:高中化学 来源: 题型:解答题
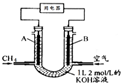 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.完成下列问题:
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的导热性能较好,应大力提倡用铝炊具 | |
| B. | 铝制器具不宜盛放食品较长时间(如放入冰箱中过夜等) | |
| C. | 明矾可用于饮用水的杀菌消毒 | |
| D. | 小孩可以食用含铝较多的食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
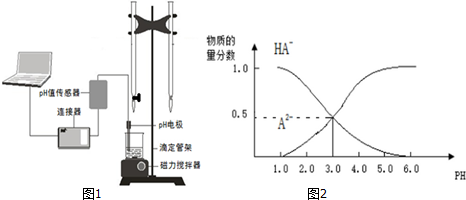
| A. | pH=4.0时,图中n(HA-)约为0.0091mol | |
| B. | 该实验应将左边的酸式滴定管换成右边碱式滴定管并加酚酞作指示剂 | |
| C. | 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0 | |
| D. | 0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH固体 | B. | NH4Cl固体 | C. | NaNO3固体 | D. | CH3COONa固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
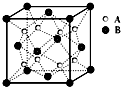 某晶体中晶体结构最小的重复单元如图:A在正方体内,B分别在顶点和面心,则该晶体的化学式为( )
某晶体中晶体结构最小的重复单元如图:A在正方体内,B分别在顶点和面心,则该晶体的化学式为( )| A. | B2A | B. | BA2 | C. | B7A4 | D. | B4A7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
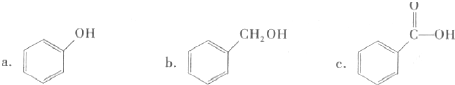
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
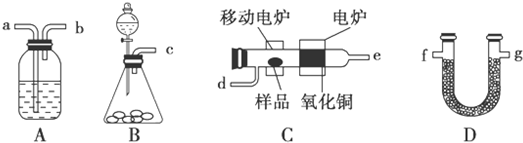
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com