
【题目】某化学兴趣小组利用工厂的铁和铜混合屑末,进行如下实验: 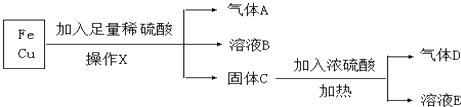
(1)操作X的名称是;
(2)气体D是;
(3)A与氧化铜加热反应生成铜和水,反应中固体的颜色变化是;A作(填“氧化剂”或“还原剂”);
(4)溶液B中的金属阳离子是 , 溶液E中阴离子除了OH﹣外还有 .
【答案】
(1)过滤
(2)SO2
(3)由黑色变为红色;还原剂
(4)亚铁离子;硫酸根离子
【解析】解:向铁、铜混合物中加入足量稀硫酸时,铁和稀硫酸反应生成硫酸亚铁、氢气,铜和稀硫酸不反应,所以A是氢气,B是硫酸亚铁溶液,C是Cu,采用过滤的方法分离不溶性固体和溶液;
在加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,所以D是二氧化硫、E是硫酸铜,(1)分离不溶性固体和溶液的方法为过滤,所以操作X的名称是过滤,故答案为:过滤;(2)通过以上分析知,气体D是SO2,故答案为:SO2;(3)A是氢气,氢气与氧化铜加热反应生成铜和水,反应方程式为:H2+CuO ![]() Cu+H2O,氧化铜是黑色固体、铜是红色固体,所以固体的颜色由黑色变为红色,该反应中H元素化合价由0价变为+1价,所以氢气是还原剂,故答案为:由黑色变为红色;还原剂;(4)溶液B中的金属阳离子是亚铁离子,溶液E是硫酸铜溶液,溶液E中阴离子除了OH﹣外还有硫酸根离子,故答案为:亚铁离子;硫酸根离子.
Cu+H2O,氧化铜是黑色固体、铜是红色固体,所以固体的颜色由黑色变为红色,该反应中H元素化合价由0价变为+1价,所以氢气是还原剂,故答案为:由黑色变为红色;还原剂;(4)溶液B中的金属阳离子是亚铁离子,溶液E是硫酸铜溶液,溶液E中阴离子除了OH﹣外还有硫酸根离子,故答案为:亚铁离子;硫酸根离子.
向铁、铜混合物中加入足量稀硫酸时,铁和稀硫酸反应生成硫酸亚铁、氢气,铜和稀硫酸不反应,所以A是氢气,B是硫酸亚铁溶液,C是Cu,采用过滤的方法分离不溶性固体和溶液;
在加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,所以D是二氧化硫、E是硫酸铜,
再结合物质的性质分析解答.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为测定一种气态烃A的分子式,取一定量的A置于密闭容器中燃烧,定性实验表明产物是二氧化碳、一氧化碳和水蒸气。学生甲、乙设计了如下两个方案,均认为根据自己的方案能求出A的实验式。他们测得的有关数据如下(图中的箭头表示气体的流向,实验前系统内的空气已排除),试回答:

(1)两种方案能否都可求出A的实验式(即C、H原子数比)_________。
(2)若能求,通过计算求出A的实验式___________________________。
(3)若要确定A的分子式,还需要测定的数据是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的位置如下表所示.下列说法正确的是( ) 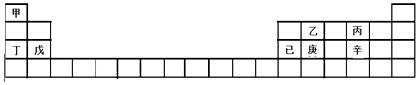
A.甲、丁、戊的单质都是金属
B.乙、丙、辛都是非金属元素
C.乙、庚、辛都能形成氧化物
D.已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用离子方程式“H++OH﹣═H2O”表示的化学反应是( )
A.4HNO3 ![]() 2H2O+4H2O↑+O2↑
2H2O+4H2O↑+O2↑
B.NaOH+HCl═NaCl+H2O
C.CaCO3+2HCl═CaCl2+CO2↑+H2
D.2H2+O2 ![]() 2H2O
2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题
(1)铵态氮肥不稳定,受热易分解.写出氯化铵(NH4Cl)受热发生分解反应的化学方程式 .
(2)乙烯能使溴水褪色,生成1,2﹣二溴乙烷(CH2 Br﹣CH2 Br).写出该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯,简称SM,是石化行业的重要基础原料,主要用于生产苯乙烯系列树脂及丁苯橡胶。苯乙烯能发生如下一系列变化。下列说法不正确的是
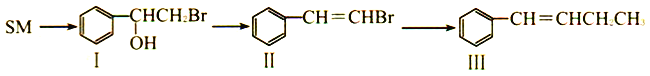
A. 有机物SM能使溴的四氯化碳溶液褪色
B. 有机物I能与金属钠反应放出H2
C. 有机物I、II均能发生氧化反应和加成反应
D. 有机物I的同分异构体中,苯环上只有一个烃基且含有碳碳双键的结构有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(g)+6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率![]() 可表示为
可表示为
A. ![]() =0.010mol/(L·s) B.
=0.010mol/(L·s) B. ![]() =0.0010 mol/(L·s)
=0.0010 mol/(L·s)
C. ![]() =0.0010 mol/(L·s) D.
=0.0010 mol/(L·s) D. ![]() =0.0045 mol/(L·s)
=0.0045 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五水硫酸铜(CuSO4·5H2O)和六水硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]都是重要的化工原料,用途十分广泛。
请回答与这两种物质中元素有关的一些问题。
(1)基态铁原子的核外电子排布式为_______;基态铜原子的电子占据的最高能层符号为_______ 。
(2)氧元素的第一电离能小于氮元素,其原因是_______ 。
(3)SO42-、H2O、NH4+三种微粒中,空间构型为正四面体的是_______;NH4+中氮原子的杂化轨道类型是_______。
(4)写出与SO42-互为等电子体的分子的化学式_______ (写一种)。
(5)Cu与Au的合金可形成面心立方最密堆积的晶体,在该晶胞中Cu原子处于面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______,若该晶体的密度为ρg.cm-3,则晶胞中Cu原子与Au原子中心的最短距离d=_______cm(NA表示阿伏加德罗常数的值)。
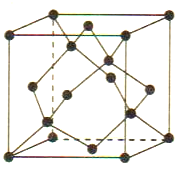
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下含碳各微粒H2CO3、HCO3﹣和CO32﹣存在于CO2和NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图所示,下列说法错误的是( ) 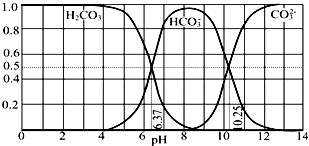
A.pH=10.25时,c(Na+)═c(CO32﹣)+c(HCO3﹣)
B.为获得尽可能纯的NaHCO3 , 宜控制溶液的pH为7~9之间
C.根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10﹣6.37
D.若是0.1mol NaOH 反应后所得的1L溶液,pH=10时,溶液中存在以下关系:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com