

 (其中:-X、-Y均为官能团).
(其中:-X、-Y均为官能团). .
. +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.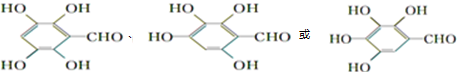 .
.分析 A能发生水解反应,则A中含有酯基,C能发生显色反应,则C中含有酚羟基,能和碳酸氢钠溶液反应生成二氧化碳,说明含有羧基;
C的结构可表示为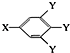 (其中:-X、-Y均为官能团),则C为
(其中:-X、-Y均为官能团),则C为 ,
,
B为醇,B的相对分子质量为60,分子中只含一个甲基,D能发生加聚反应生成高分子化合物,D中含有不饱和键,B发生消去反应生成D,结合其分子式知,B结构简式为CH3CH2CH2OH,D为CH2=CHCH3,E结构简式为 ,则可推知A为
,则可推知A为 ,据此分析解答.
,据此分析解答.
解答 解:A能发生水解反应,则A中含有酯基,C能发生显色反应,则C中含有酚羟基,能和碳酸氢钠溶液反应生成二氧化碳,说明含有羧基;
C的结构可表示为 (其中:-X、-Y均为官能团),则C为
(其中:-X、-Y均为官能团),则C为 ,
,
B为醇,B的相对分子质量为60,分子中只含一个甲基,D能发生加聚反应生成高分子化合物,D中含有不饱和键,B发生消去反应生成D,结合其分子式知,B结构简式为CH3CH2CH2OH,D为CH2=CHCH3,E结构简式为 ,则可推知A为
,则可推知A为 ,
,
(1)B为CH3CH2CH2OH,根据系统命名法,B的名称为1-丙醇,故答案为:1-丙醇;
(2)-X为-COOH,官能团-X的名称为羧基,故答案为:羧基;
(3)A的结构简式为 ,故答案为:
,故答案为: ;
;
(4)C为 ,含有羧基的物质可以和碳酸氢钠发生反应生成二氧化碳,所以
,含有羧基的物质可以和碳酸氢钠发生反应生成二氧化碳,所以 和碳酸氢钠发生反应的化学方程式为:
和碳酸氢钠发生反应的化学方程式为: +NaHCO3→
+NaHCO3→ +H2O+CO2↑,
+H2O+CO2↑,
故答案为: +NaHCO3→
+NaHCO3→ +H2O+CO2↑;
+H2O+CO2↑;
(5)C为 ,C的同分异构体符合下列条件:
,C的同分异构体符合下列条件:
Ⅰ.含有苯环,Ⅱ.能发生银镜反应说明含有醛基,
Ⅲ.不能发生水解反应,说明不含酯基,
则符合条件C的同分异构体有 ,
,
故答案为: ;
;
(6)A具有抗氧化作用的主要原因是分子中有酚羟基,因为苯酚在空气中易被氧化为粉红色,故答案为:c.
点评 本题考查有机物推断,侧重考查学生分析推断及知识迁移能力,为高考高频点,根据反应条件、相对分子质量及题给信息进行推断,难点是同分异构体种类判断,熟练掌握常见有机化学反应类型,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ② | C. | ②③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ,②的反应类型为加成反应
,②的反应类型为加成反应
 (或
(或 )
)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 用铜作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 氯化钠与浓硫酸混合加热:H2SO4+2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:
(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | KCIO3(g) | 催化剂 | 产生气体(mL) (已折算到标准情况) | 耗时(S) | ||
| 化学式 | 质量(g) | 回收 | ||||
| ① | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| ② | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| ③ | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| ④ | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
| 提出猜想 | 该刺激性气味的气体单质可能是Cl2 |
| 设计实验 验证猜想 | 实验步骤和结论(不要求写具体操作过程)将燃着的小木条插进集气瓶中,直至木条熄灭,用玻璃棒粘着湿润的碘化钾淀粉试纸插进集气瓶中.若试纸变蓝则证明是Cl2,否则不是氯气: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着元素相对原子质量的递增,量变引起质变 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素原子的核外电子排布呈周期性变化 | |
| D. | 元素的金属性和非金属性呈周期性变化. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com