
【题目】有一处于平衡状态的反应:X(s)+3Y(g)![]() 2Z(g);△H<0.为了使平衡向生成Z的方向移动,应选择的条件是( )
2Z(g);△H<0.为了使平衡向生成Z的方向移动,应选择的条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z ⑦增加X ⑧增加Y
A.①③⑤⑦B.②③⑤⑦C.②③⑥⑧D.②④⑥⑧
【答案】C
【解析】
反应X(s)+3Y(g)![]() 2Z(g),△H<0,正反应是气体物质的量减小的放热反应,根据勒夏特列原理:
2Z(g),△H<0,正反应是气体物质的量减小的放热反应,根据勒夏特列原理:
①升高温度,平衡逆向移动,①错误;
②降低温度,平衡向正反应移动,②正确;
③压强增大,平衡向正反应移动,③正确;
④降低压强,平衡向逆反应方向移动,④错误;
⑤加催化剂缩短到达平衡的时间,不会引起化学平衡的移动,⑤错误;
⑥分离出Z,即减小生成物的浓度,平衡正向移动,⑥正确;
⑦增加X,X为固体,平衡不移动,⑦错误;
⑧增加Y,Y的浓度增大,平衡向右移动,⑧正确;
反应X(s)+3Y(g)2Z(g),△H<0,正反应是气体物质的量减小的放热反应,根据勒夏特列原理:①升高温度,平衡逆向移动,①错误;②降低温度,平衡向正反应移动,②正确;③压强增大,平衡向正反应移动,③正确;④降低压强,平衡向逆反应方向移动,④错误;⑤加催化剂缩短到达平衡的时间,不会引起化学平衡的移动,⑤错误;⑥分离出Z,即减小生成物的浓度,平衡正向移动,⑥正确;⑦增加X,X为固体,平衡不移动,⑦错误;⑧增加Y,Y的浓度增大,平衡向右移动,⑧正确。答案为C


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。
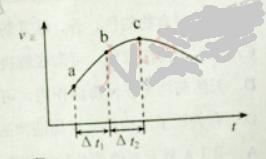
A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氮化镓(GaN)、砷化镓(GaAs)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点,如砷化镓灯泡寿命是普通灯泡的100倍,而耗能仅为10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。请回答下列问题:
(1)镓为元素周期表第31号元素,基态镓原子的电子排布式为___________,核外电子占据最高能层符号为________。
(2)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以_______键相结合,氮化镓属于_______晶体。
(3)下列说法正确的是_______
A.第一电离能:As < Ga B.砷和镓都属于p区元素
C.电负性:As < Ga D.半导体GaP、SiC与砷化镓为等电子体
(4)①砷化镓是将(CH3)3Ga和AsH3用MOCVD(金属有机物化学气相淀积)方法制备得到的,该反应在700℃进行,反应的方程式为:____________________。
②反应物AsH3分子的几何构型为_______,(CH3)3Ga中镓原子杂化方式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示物质是一种重要的化工原料。下列有关该有机化合物的叙述正确的是( )
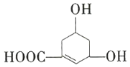
A.该有机化合物的分子式为![]()
B.能使溴的![]() 溶液、酸性
溶液、酸性![]() 溶液褪色
溶液褪色
C.能发生酯化反应
D.具有相同种类和数量的官能团的结构共有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热△H=﹣890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ/mol
B. 一定条件下,将0.5 molN2和1.5molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ/mol
2NH3(g)△H=﹣38.6kJ/mol
C. 已知2C(s)+2O2(g) ═2CO2(g);△H1;2C(s)+O2(g)=2CO(g) △H2 则△H1>△H2
D. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A.测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度
B.若![]() ,则碳的燃烧热为
,则碳的燃烧热为![]()
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.在稀溶液中:![]() ,含
,含![]() 的浓硫酸与含
的浓硫酸与含![]() 的溶液混合,放出的热量小于
的溶液混合,放出的热量小于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。

(1)B分子中官能团的名称是________,D中官能团的名称是_________;反应①的反应类型是__________反应。
(2)反应②的化学方程式是________________________________________,反应⑤的化学方程式是_________________________________________________。
(3)①某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体。上述实验中试管甲中试剂为___________________,其作用是(填字母)_____________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
②在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,_____(能/不能)生成1mol 乙酸乙酯,原因是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图象说法正确的是
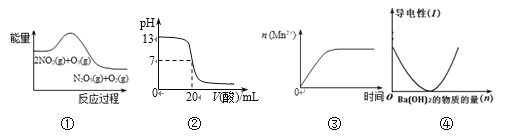
A. ①表示化学反应2NO2(g) + O3(g) = N2O5(g) + O2(g) ΔH > 0
B. ②表示25℃时,用0.1 mol/L CH3COOH溶液滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化
C. ③表示10 mL 0.01 mol/L酸性KMnO4溶液与过量的0.1 mol/L H2C2O4溶液混合时, n (Mn2+) 随时间的变化
D. ④可表示向稀硫酸溶液中滴加氢氧化钡溶液,溶液导电性随氢氧化钡物质的量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
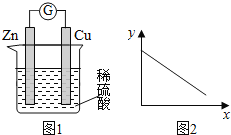
A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com