
| ���� | ��ʼ���� | ������ȫ |
| Fe��OH��2 | 2.7 | 3.7 |
| Fe��OH��2 | 7.6 | 9.6 |
| Mn��OH��2 | 8.3 | 9.8 |
| ||
| �� |
| ||
| �� |
| ||
| �� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| NH3?H2O��Kb | Zn 2+��ȫ������pH | Zn��OH��2���ڼ��pH |
| 1.8��10-5 | 8.9 | ��11 |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| �� �� | ��ʼ���� | ������ȫ |
| Fe��OH��3 | 2.7 | 3.7 |
| Fe��OH��2 | 7.6 | 9.6 |
| Mn��OH��2 | 8.3 | 9.8 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ̩���и�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
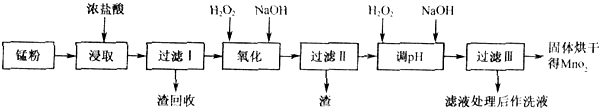
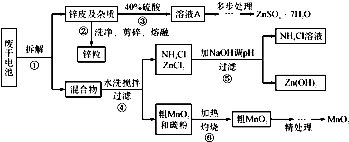
�Ͼ���Ļ������ü������ڽ�Լ��Դ���������ڱ���������ij�о�С��ͬѧ�ԷϾ�п�̸ɵ��Ϊԭ�ϣ����Ͼɵ�غ�п����ת����ZnSO4��7H2O�����̲���ת���ɴ��Ƚϸߵ�MnO2����NH4Cl��ҺӦ���ڻ��������У�ʵ���������£�

��1�������������õļ�������Ӧѡ ��ѡ�����������������
��2������ҺA�����ĵ�һ���Ǽ��백ˮ����pHΪ9��ʹ���е�Fe3+��Zn2+��������д����ˮ��Fe3+��Ӧ�����ӷ���ʽ ��
��3����������Ϊ�˳�ȥ��Һ�е�Zn2+����֪25��ʱ��
|
NH3��H2O��Kb |
Zn2+��ȫ������pH |
Zn(OH)2���ڼ��pH |
|
1.8��10��5 |
8.9 |
��11 |
���ϱ����ݷ���Ӧ������ҺpH���Ϊ ������ţ���
a��9 b��10 c��11
��4�� MnO2����������Ҫ���裺
����1����3%H2O2��6.0mol/L��H2SO4�Ļ��Һ����MnO2�ܽ⣬���ȳ�ȥ����H2O2����MnSO4��Һ��������Fe3+������Ӧ����MnSO4�����ӷ���ʽΪ ��
����2����ȴ�����£��μ�10%��ˮ����pHΪ6��ʹFe3+������ȫ���ټӻ���̿���裬���ˡ��ӻ���̿�������� ��
����3������Һ�еμ�0.5mol/L��Na2CO3��Һ������pH��7���˳�������ϴ�ӡ�����������ں�ɫ������MnO2�����չ����з�Ӧ�Ļ�ѧ����ʽΪ ��
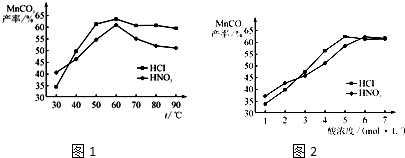
��5�� ������֪����MnO2���ܽ�������������������ݣ�Ȼ����ȡMnCO3���塣
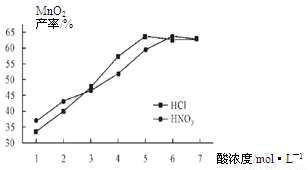
���������������Һ��Ũ�Ⱦ�Ϊ5mol/L�������Ⱥ���ѽ���ʱ���£������¶ȶ�MnCO3���ʵ�Ӱ����ͼ4����ͼ�������������ѽ����¶ȶ��� �����ң�
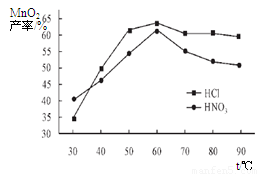
��������¶ȡ���ѽ���ʱ����������£����Ũ�ȶ�MnCO3���ʵ�Ӱ����ͼ5����ͼ������������Ũ��Ӧѡ�� mol/L���ҡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| NH3?H2O��Kb | Zn 2+��ȫ������pH | Zn��OH��2���ڼ��pH |
| 1.8��10-5 | 8.9 | ��11 |

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com