
(13分)冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如下图: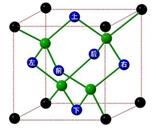
(1)一个水分子含_____个孤电子对,水分子能与很多金属离子形成配合物,请写出它与铜离子形成的一种蓝色的配合物离子的化学式为__________。
(2)每个冰晶胞平均占有____个水分子,冰的熔点远低于金刚石熔点的原因是__________________。
(3)实验测得冰中氢键的作用力为18.5 kJ/mol,而冰的熔化热为5.0 kJ/mol,这说明冰熔化成水,氢键_________(填全部或部分)被破坏。
(4)假如冰晶胞边长为a cm,则冰的密度是________________g·cm-3
(阿伏伽德罗常数用NA表示)。
(1) 2 (2分) [Cu(H2O)4]2+(2分)
(2)8(2分);破坏的作用力不同,金刚石融化需要破坏共价键,而冰融化需要破坏氢键(和分子间作用力)(2分)
部分(2分)
144/a3NA (3分)
解析试题分析:(1)水分子中O原子最外层含有2个未成对电子,还有2个孤电子对;铜离子形成配合物时的配位数为4,则配合物离子的化学式为;[Cu(H2O)4]2+。
(2)根据晶胞示意图,可知H2O分子位置:顶点为8个,面心为6个,晶胞内有4个,根据均摊法,每个冰晶胞平均含有水分子数为:8×1/8+6×1/2+4=8;冰晶体中水分子间作用力为氢键,金刚石晶体中C原子间作用力为化学键,化学键的作用远远大于氢键,所以冰的熔点远低于金刚石熔点。
(3)冰中氢键的作用能为18.5kJ?mol-1,而冰熔化热为5.0kJ?mol-1,说明冰熔化为液态水时只是破坏了一部分氢键,液态水中仍在氢键。
(4)以1个冰晶胞为研究对象,冰的密度=8×18÷NA÷a3=144/a3NA。
考点:本题考查分子与配合物结构、晶胞的结构及计算、熔点的比较。


科目:高中化学 来源: 题型:单选题
下列有关化学键与晶体结构的说法正确的是
| A.两种元素组成的分子中一定只有极性键 |
| B.离子化合物的熔点一定比共价化合物的高 |
| C.非金属元素组成的化合物一定是共价化合物 |
| D.含有阴离子的化合物一定含有阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是
| A.2Na2O2+2CO2=2Na2CO3+O2 | B.2Na+2H2O=2NaOH+H2↑ |
| C.Cl2+H2O?=?HCl+HclO | D.Na2CO3+BaCl2=BaCO3↓+2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求回答下列问题:
(1)有下列六种物质:①碳60(C60)晶体②硼晶体③Na2O晶体④ CaF2晶体⑤P4O10晶体⑥碳化硅晶体。其中属于离子晶体的是 ,属于分子晶体的是 ,属于原子晶体的是____。
(2)有下列分子:HCN、P4、SO3、PCl3、BF3,其中属于非极性分子的是 。
(3)有下列离子:SO32-、SO42-、CO32-,其中VSEPR模型为正四面体形的是 ,中心原子的杂化轨道类型属于sp2杂化的是 。
(4)CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为______;与每一个钙离子距离最近并且距离相等的钙离子有____个 ;CaO晶体和NaCl晶体的晶格能分别为:CaO:3 401 kJ/mol、NaCl:786 kJ/mol。导致两者晶格能差异的主要原因_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)有下列七种物质:①Cl2 ②Na2O2 ③H2O2 ④NH4Cl ⑤CH4 ⑥NaHSO4 ⑦Ne
回答下列问题
(1)不存在化学键的是_______________;(填序号)
(2)含有极性键和非极性键的是_______________;(填序号)
(3)NaHSO4固体溶于水,破坏了_____________键;其电离方程式为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在20℃、1个大气压下,水可以结成冰,称为“热冰”。图Ⅰ是水和“热冰”的计算机模拟图,图中球代表水分子中的原子。
图Ⅰ
(1)图中较大的球代表________原子,其原子结构示意图是________。水分子中氢氧原子间的化学键是________(填“共价键”或“离子键”)。
(2)用球棍模型表示的水分子结构是________。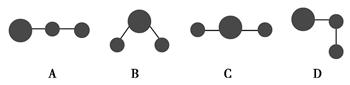
图Ⅱ
(3)已知水分子中氧原子一端带部分负电荷,氢原子一端带部分正电荷,在外加电场作用下,水结成冰。图Ⅰ中模拟“热冰”的示意图是________(填“图1”或“图2”),理由是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.(1)写出下列电子云的界面图表示的形成的键的类型:
①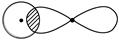
_________________________________________________________________。
②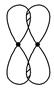
_________________________________________________________________。
③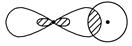
_________________________________________________________________。
④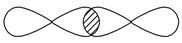
_________________________________________________________________。
(2)下列分子中,没有光学活性的是____________,含有两个手性碳原子的是
____________。
| A.乳酸CH3—CHOH—COOH |
| B.甘油CH2OH—CHOH—CH2OH |
| C.脱氧核糖CH2OH—CHOH—CHOH—CH2—CHO |
| D.核糖CH2OH—CHOH—CHOH—CHOH—CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关金属的说法正确的是
| A.金属原子的核外电子在金属晶体中都是自由电子 |
| B.已知金属钠的晶体堆积模型是体心立方堆积,则其配位数是6 |
| C.已知金属镁的晶体堆积模型是六方最密堆积,则其配位数是12 |
| D.金属导电的实质是金属阳离子在外电场作用下的定向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com