
 分子模型可以直观地表现分子结构的特点.如图表示某烃分子的一种模型,有关说法中正确的是( )
分子模型可以直观地表现分子结构的特点.如图表示某烃分子的一种模型,有关说法中正确的是( )| A. | 该图表示的是乙烯分子的球棍模型 | |
| B. | 该烃分子是非极性分子 | |
| C. | 该烃的电子式为: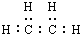 | |
| D. | 该烃分子中半径较大的原子其核外电子排布的轨道表示式为: |
分析 A.图示为比例模型,不是球棍模型;
B.乙烯为平面三角形结构,键角为120°,且为非极性分子;
C.乙烯分子中存在碳碳双键,表示碳碳单键;
D.乙烯中半径较大原子为C,碳原子的2p轨道优先占据1个轨道,且自旋方向相同.
解答 解:A.图示为乙烯的比例模型,不是球棍模型,故A错误;
B.乙烯分子为平面三角形结构,键角都是120°,由于分子结构对称,乙烯为非极性分子,故B正确;
C.烯的分子式为C2H4,分子中碳原子与碳原子通过两对共用电子对相连接,碳原子与氢原子通过一对共用电子对相连接,所以乙烯的电子式为 ,故C错误;
,故C错误;
D.C原子的1s、2s、2p能量升高,2p轨道中电子优先单独占据1个轨道,且自旋方向相同,能量最低,正确的核外电子排布的轨道表示式为: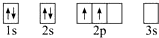 ,故D错误;
,故D错误;
故选B.
点评 本题考查了电子式、比例模型、核外电子排布轨道的表示方法判断,题目难度中等,注意掌握常见化学用语的表示方法,明确比例模型的概念及表示方法是解答本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
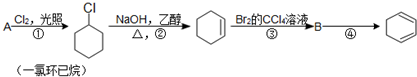
 ,名称是环己烷.
,名称是环己烷. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仍平衡 | B. | 盛钠的一端下沉 | C. | 盛镁的一端下沉 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl+NaOH$\frac{\underline{\;△\;}}{\;}$NH3↑+H2O+NaCl | B. | 3CO+Fe2O3$\frac{\underline{\;△\;}}{\;}$2Fe+3CO2 | ||
| C. | Cl2+2KBr═Br2+2KCl | D. | NH3+CO2+H2O═NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.| X | Y | Z | |
| W |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
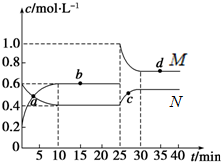 W、X、Y、Z分别为H、C、N、O元素.
W、X、Y、Z分别为H、C、N、O元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
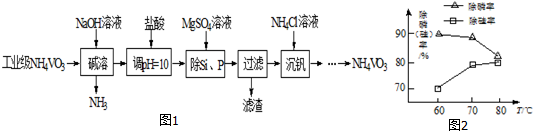
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
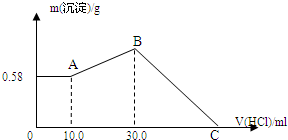 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入0.5mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入0.5mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体的分子个数之比为17:16 | |
| B. | 两种气体的原子个数之比为17:16 | |
| C. | 两种气体的氢原子个数之比为17:12 | |
| D. | 同温同压下,两种气体的体积之比为17:16 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com