
 U是制造原子弹的材料和核反应堆的燃料。
U是制造原子弹的材料和核反应堆的燃料。 U的原子核内的中子数与核外电子数之差是( )
U的原子核内的中子数与核外电子数之差是( )| A.235 | B.143 | C.92 | D.51 |
科目:高中化学 来源:不详 题型:单选题
| A.13C与14C互为同位素,化学性质相同,但相对原子质量一定不同 |
| B.某元素原子次外层电子数是最外层电子数的2倍,则该元素氧化物为酸性氧化物 |
| C.IA族元素与VIIA元素形成的化合物都为离子化合物 |
| D.短周期中,同周期元素的离子半径从左到右逐渐减少 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若X是原子晶体,Y是分子晶体,则熔点:X<Y |
| B.若A2+2D-→2A-+D2,则氧化性:D2>A2 |
| C.若R2-和M+的电子层结构相同,则原子序数:R>M |
| D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
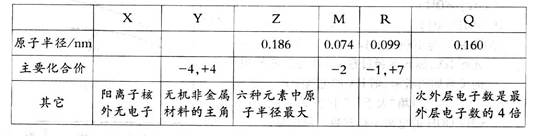
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.p区、第五周期、ⅠB族 | B.d区、第五周期、ⅦB族 |
| C.d区、第四周期、ⅠB族 | D.ds区、第五周期、ⅠB族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (未完成)。
(未完成)。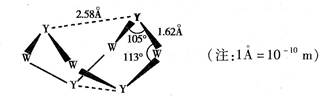
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 。
。 为Y。在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X Y(填“>”、“=”或“<”)
为Y。在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X Y(填“>”、“=”或“<”)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com