
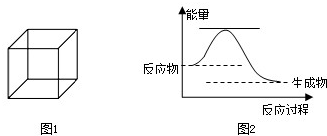
 (1)立方烷的结构简式如图1所示,每个顶点是一个碳原子.则:
(1)立方烷的结构简式如图1所示,每个顶点是一个碳原子.则: ,
, .
.


科目:高中化学 来源: 题型:
| A、①③ | B、①②③④ | C、②④ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X中一定不存在FeO |
| B、不容物Y中一定含有FeO和CuO |
| C、Z溶液中一定存在K2CO3 |
| D、Y中一定存在MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ |
| B、②③⑤④① |
| C、⑤①②③④ |
| D、⑤③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用过滤的方法除去食盐中的泥沙 |
| B、用分液的方法分离汽油和水 |
| C、用结晶的方法分离氯化钠和硝酸钾 |
| D、用加热的方法除去碳酸氢钠中混有的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.52 | 25.42 |
| 第二次 | 20.00 | 4.07 | 29.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com