
【题目】含氮化合物在生活、生产和科技等方面有重要的应用。
⑴已知298 K时,亚硝酸(HNO2)的电离平衡常数Ka=5.1×10-4,H2CO3的电离平衡常数 Ka1=4.2×10-7、Ka2=5.61×10-11。
① NaNO2溶液呈____(填“酸性”“碱性”或“中性”),原因是_________(用离子方程式表示)。
②向含有1 mol碳酸钠的溶液中加入1 mol HNO2后,溶液中c(CO32-)、c(HCO3-)、c(NO2-)由大到小的顺序为________________。
(2)电化学催化净化NO是处理含氮化合物的一种新方法,原理如图所示,固体电解质起到传导O2-的作用。b极为电源的_____(填“正极”或“负极”),通入NO的电极上的电极反应式为______。

⑶N2O5是绿色硝化剂,能溶于水生成硝酸。常温下,向0.1 mol·L-1的氨水中加入少量N2O5,使溶液中c(NH3H2O):c(NH4+)=5 : 9,此时溶液中 c(NH4+)+c(H+) — c(NO3-)=_____。 (25℃时,NH3H2O的电离常数Kb=1.8×10-5)
【答案】 碱性 NO2-+H2O=HNO2+OH- c(NO2-)>c(HCO3-)>c(CO32-) 正极 2NO+4e-=N2+2O2- 1.0×10-5 mol·L-1
【解析】⑴①根据亚硝酸(HNO2)的电离平衡常数Ka=5.1×10-4,亚硝酸为弱酸,NaNO2溶液水解显碱性,故答案为:碱性;NO2-+H2O=HNO2+OH-;
②由亚硝酸的电离平衡常数Ki=5.1×10-4,H2CO的Ki1=4.2×10-7,Ki2=5.61×10-11,向含有1 mol碳酸钠的溶液中加入1 mol HNO2后,生成亚硝酸钠和碳酸氢钠,水解程度大小顺序为HCO3->NO2-,碳酸氢钠溶液显碱性,电离程度小于水解程度,所以溶液中CO32-离子、HCO3-离子和NO2-离子的浓度大小关系为c(NO2-)>c(HCO3-)>c(CO32-),故答案为:c(NO2-)>c(HCO3-)>c(CO32-);
(2)反应原理是利用电解吸收NO生成氮气,氮元素化合价+2价变化为0价,发生还原反应,在电解池的阴极发生还原反应,则a为外接电源的负极,b极为外接电源的正极,固体电解质起到传导作用的是O2-,通入NO的电极反应式为2NO+4e-=N2+2O2-,故答案为:正;2NO+4e-=N2+2O2-;
⑶N2O5能溶于水生成硝酸。向0.1 mol·L-1的氨水中加入少量N2O5,氨气与硝酸反应生成硝酸铵,溶液中c(NH3H2O):c(NH4+)=5 : 9,即c(NH4+)=![]() mol/L ,c(NH3H2O)=
mol/L ,c(NH3H2O)= ![]() mol/L ,根据NH3H2O的电离常数Kb=1.8×10-5,有Kb=1.8×10-5=
mol/L ,根据NH3H2O的电离常数Kb=1.8×10-5,有Kb=1.8×10-5=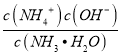 =
=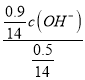 ,解得c(OH-)=1.0×10-5 mol/L,根据电荷守恒c(NH4+)+c(H+) — c(NO3-)= c(OH-)=1.0×10-5 mol/L,故答案为:1.0×10-5 mol/L。
,解得c(OH-)=1.0×10-5 mol/L,根据电荷守恒c(NH4+)+c(H+) — c(NO3-)= c(OH-)=1.0×10-5 mol/L,故答案为:1.0×10-5 mol/L。


科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机盐X (仅含有五种元素,且含有结晶水)的组成和性质。设计并完成了如下实验:

另将生成的气体甲与过量灼热氧化铜粉末反应,生成两种单质,再将产物通入浓硫酸洗气后测得标况下的气体乙为0.224L。请回答如下问题:
(1)X的化学式是___________, 固体2中存在的化学键类型________________________
(2)溶液2中通入过量气体甲时发生的离子反应方程式___________________________
(3)在一定条件下,生成的气体甲与过量氧化铜还能发生另一氧化还原反应,生成的气体乙在标况下的体积仍为0.224L, 写出该反应的化学方程式___________
(4)请设计实验证明无机盐X中存在的金属阳离子________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3—CH===CH—Cl,该有机物能发生①取代反应;②加成反应;③消去反应;④使溴水褪色;⑤使酸性KMnO4溶液褪色;⑥与AgNO3溶液生成白色沉淀;⑦聚合反应
A. 以上反应均可发生 B. 只有①不能发生
C. 只有③不能发生 D. 只有⑥不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各有机物的数目与分子式C4H7ClO2且能与NaHCO3溶液反应生成CO2的有机物的数目(不考虑立体异构)相同的是
A. 分子式为C5H10的烯烃 B. 甲苯的一氯代物
C. 相对分子质量为74的一元醇 D. 立方烷(![]() )的二硝基取代物
)的二硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六种基团:①苯基 ②醛基 ③羟基 ④羧基 ⑤乙基 ⑥氯原子(-Cl)这六种基团两两结合,可形成新的化合物,写出符合下列条件的化合物的结构简式。
(1)分子内氧原子数不超过2个,具有酸性,但不能和碳酸氢钠反应________________。
(2)分子内氧原子数不超过2个,能发生银镜反应的物质,除苯甲醛和甲酰氯(Cl-CHO)外还有______________、 ____________。
(3)不稳定的两元弱酸__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷是氮族元素,黄砷(As4)是其一种单质,其分子结构与白磷(P4)相似,以下关于黄砷与白磷的比较叙述正确的是
A. 黄砷中共价键键能大于白磷 B. 黄砷的熔点高于白磷
C. 黄砷易溶于水 D. 分子中共价键键角均为109°28′
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。

(1)关于该反应的下列说法中,其△H____0。(填“大于”、“小于”或“等于”), 且在_______(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)该反应平衡常数K的表达式为______________________
(3)温度降低,平衡常数K_____________(填“增大”、“不变”或“减小”)。
(4)若为两个容积相同的密闭容器,现向甲容器中充入1 mol CO2(g)和3 molH2(g),乙容器中充入1molCH3OH(g)和1molH2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH )_________(填“大于”“小于”或“等于”)乙容器内n(CH3OH )
(5)以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池。
①负极的电极反应式为_______________________
②若以石墨为电极,电解硫酸铜溶液,写出电解的化学反应方程式___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com