
| A. | 若1molSO2和1molO2充分反应,转移的电子数为2×6.02×1023 | |
| B. | 在钢铁表面涂刷含铝粉的防锈漆,可以有效防止钢铁腐蚀 | |
| C. | 在室温下,向醋酸溶液中不断通入NH3,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$不断减小 | |
| D. | 室温下,反应Cl2(g)+H2O(l)═HCl(aq)+HClO(aq) 能自发进行,则△H>0 |
分析 A、二氧化硫与氧气反应生成三氧化硫,属于可逆反应,反应不能进行完全;
B、原电池的负极金属易被腐蚀,正极上的金属被保护;
C、在室温下,向醋酸溶液中不断通入NH3,可以和醋酸之间反应得到醋酸铵溶液;
D、△G=△H-T△S<0,反应能自发进行.
解答 解:A、二氧化硫与氧气反应生成三氧化硫,属于可逆反应,反应不能进行完全,该反应中转移的电子数小于2×6.02×1023,故A错误;
B、原电池的负极金属易被腐蚀,正极上的金属被保护,在钢铁表面涂刷含铝粉的防锈漆,此时金属铝是负极,被腐蚀,金属铁是正极,被保护,这样可以有效防止钢铁腐蚀,故B正确;
C、醋酸的电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,只受温度的影响,在室温下,向醋酸溶液中不断通入NH3,可以和醋酸之间反应得到醋酸铵溶液,醋酸根离子浓度增加,所以醋酸和氢离子之间浓度的比值逐渐增大,故C错误;
D、△G=△H-T△S<0,反应能自发进行,反应Cl2(g)+H2O(l)═HCl(aq)+HClO(aq),此时能自发进行,△S<0,所以△H<0,故D错误.
故选B.
点评 本题涉及电解质的电离平衡、可逆反应的特点、原电池原理的应用以及反应自法进行的方向等知识,属于综合知识的考查,难度中等.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 制造普通玻璃的原料是纯碱、石灰石和石英 | |
| B. | 以粮食为原料酿酒过程的变化包括粮食→淀粉→葡萄糖→乙醇 | |
| C. | 二氧化硫有漂白性,可以使蓝色石蕊试纸褪色 | |
| D. | 漂白精、臭氧和活性炭都能用于游泳池的消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
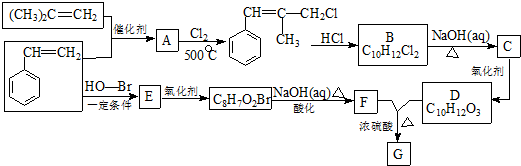
 .
.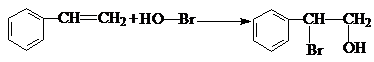 .
.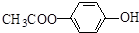 和
和 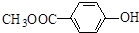 .
.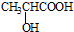 )的合成线路:
)的合成线路:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
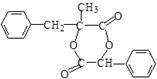
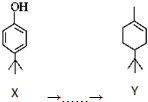 ,下列叙述正确的是( )
,下列叙述正确的是( )| A. | 化合物Y中含有1个手性碳原子 | |
| B. | 用FeCl3溶液可鉴别化合物X和Y | |
| C. | 1molX与溴水反应最多消耗1molBr2 | |
| D. | 在一定条件,化合物X、Y均可以发生缩聚反应和加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液中:Ba2+、K+、CO32-、NO3- | |
| B. | 0.1 mol•L-1NaHCO3溶液中:K+、NH4+、Cl-、SO42- | |
| C. | 0.1 mol•L-1FeCl3溶液中:Al3+、Cu2+、Br-、I- | |
| D. | 由水电离产生的c(H+)=1×10-13的溶液中:Na+、Mg2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
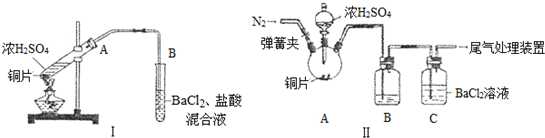
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 只有①②④ | C. | 只有①③⑤ | D. | 只有①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | R | |
| W |
| A. | 五种元素的原子最外层电子数一定大于2 | |
| B. | 五种元素一定都是非金属元素 | |
| C. | R 的最高价氧化物对应的水化物一定是强酸 | |
| D. | X的氢化物沸点一定比Z的氢化物沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
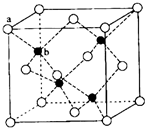 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题: (若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
(若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com