
分析 根据n=$\frac{V}{{V}_{m}}$计算出混合气体的物质的量;设出CO和CO2的物质的量,然后分别根据气体总物质的量、总质量列式计算;根据m=nM计算出CO的质量,再计算出CO的质量分数.
解答 解:标准状况下39.2L CO和CO2的混合气体的物质的量为:$\frac{39.2L}{22.4L/mol}$=1.75mol,
设混合气体中CO和CO2的物质的量分别为x、y,
则:$\left\{\begin{array}{l}{28x+44y=61}\\{x+y=1.75}\end{array}\right.$,解得:$\left\{\begin{array}{l}{x=1mol}\\{y=0.75mol}\end{array}\right.$
即混合气体中CO为1mol,二氧化碳的物质的量为0.75mol,
1molCO的质量为:28g/mol×1mol=28g,则混合气体中CO的质量分数为:$\frac{28g}{61g}$×100%≈45.9%,
故答案为:1.75;0.75;45.9%.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积之间的转化关系为解答关键,注意掌握质量分数的概念及表达式,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 氯化铝溶液 | C. | 稀氨水 | D. | 饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
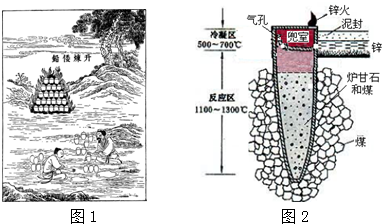
| A. | “泥封”的目的是为了防止得到的锌被氧化 | |
| B. | “锌火”是锌蒸气和一氧化碳在空气的燃烧 | |
| C. | 冶炼时锌变为蒸气在兜室冷凝为固体 | |
| D. | 升炼倭铅过程包含分解反应和氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
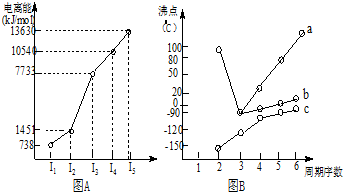
| A. | ①③⑤ | B. | ②⑤ | C. | ④⑤ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、SO42-、Ba2+、Cl- | B. | Na+、K+、CH3COO-、NO3- | ||
| C. | H+、Cu2+、OH-、CO32- | D. | K+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用HR做导电实验,灯泡很暗 | |
| B. | 0.1mol•L-1HR溶液稀释到100倍时,溶液的pH值为3 | |
| C. | 20mL0.1mol•L-1HR恰好中和20mL0.1mol•L-1NaOH溶液 | |
| D. | 0.1mol•L-1NH4R溶液的pH等于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 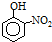 | 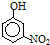 | 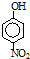 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com