
取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960 mL的NO2气体和672 mL的N2O4气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02 g。下列判断不正确的是( )
A.参加反应的硝酸是0.92 mol
B.合金中镁的质量5.9 g
C.反应过程中转移的电子数为0.46 mol
D.合金中含有铜0.092 mol
B
【解析】本题考查硝酸的性质及有关计算,中等难度。由生成NO2和N2O4的体积可得二者物质的量分别为0.4 mol 和0.03 mol,则硝酸得电子的物质的量为0.46 mol,即反应过程中转移的电子为0.46 mol,C正确。设铜和镁的物质的量分别为a和b,则根据电子得失守恒可得2a+2b=0.46 mol,生成沉淀分别为氢氧化铜和氢氧化镁,由质量可得a·98 g/mol+b·58 g/mol=17.02 g,解两个方程式得a=0.092 mol,b=0.138 mol,即合金中含有铜0.092 mol,含有镁0.138 mol,镁的质量为3.312 g,故B错误,D正确。硝酸反应时表现酸性的为0.46 mol,表现氧化性的为0.46 mol,所以参加反应的硝酸是0.92 mol,A正确。解决有关硝酸的计算题要建立守恒的思想,该题中用到了电子守恒和原子守恒。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷(解析版) 题型:选择题
某同学取等体积的稀盐酸与稀醋酸各一份进行稀释,下面是稀释前后的有关数据及结论,其中肯定错误的是( )
ABCD
稀释前酸浓度相同酸浓度相同pH均为3pH均为3
稀释量均为10倍稀释至两酸pH相同稀释至pH均为5均为100倍
结论pH:盐酸的小稀释倍数:盐酸的大稀释倍数:盐酸的大pH:盐酸的大
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:选择题
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是 ( )
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动
D.总反应为:2 Li+2H2O=2 LiOH+H2↑
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题5微观结构与物质的多样性练习卷(解析版) 题型:选择题
短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如右图所示,其中戊是同周期中原子半径最小的元素。下列有关判断正确的是( )

A.最外层电子数:甲>乙>丙>丁>戊
B.简单离子的离子半径:戊>丁
C.含有丁元素的酸有多种
D.乙的氢化物多种多样,丙、丁、戊的氢化物各有一种
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(解析版) 题型:填空题
印刷电路的废腐蚀液中含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)测得某废腐蚀液中含CuCl2 1.5 mol·L-1、FeCl2 3.0 mol·L-1、FeCl3 1.0 mol·L-1、HCl 3.0 mol·L-1。
取废腐蚀液200 mL按如下流程在实验室进行实验:
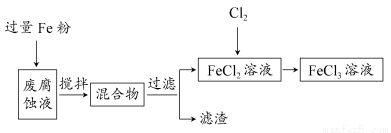
回答下列问题:
①废腐蚀液中加入过量铁粉后,发生反应的离子方程式为________。
②检验废腐蚀液中含有Fe3+的实验操作是________;在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、________。
③由滤渣得到纯铜,除杂所需试剂是________。
(2)某化学兴趣小组利用下图所示装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
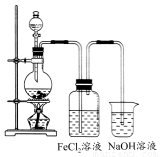
①实验开始前,某同学对实验装置进行了气密性检查,方法是________。
②浓盐酸与二氧化锰加热反应的化学方程式为________;烧杯中NaOH溶液的作用是________。
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于________g,需通入Cl2的物质的量应不少于________ mol。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(解析版) 题型:选择题
将1.12 g铁粉加入25 mL 2 mol/L的FeCl3溶液中,充分反应后,其结果是( )
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.向溶液中滴入无色的KSCN溶液,显血红色
C.Fe2+和Fe3+的物质的量之比为5:1
D.氧化产物与还原产物的物质的量之比为2:5
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(解析版) 题型:选择题
硅作为一种新型能源被广泛开发利用,关于其有利因素下列说法中,你认为不正确的是( )
A.硅燃烧产物对环境产生的污染,容易得到有效控制
B.从Si(s)+O2(g)  SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
C.自然界中硅的贮存量丰富,可以从自然界直接获得单质硅
D.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题2从海水中获得的化学物质练习卷(解析版) 题型:选择题
如图所示,四条直线分别表示钠、镁、铝、铁与足量Cl2反应时消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是( )
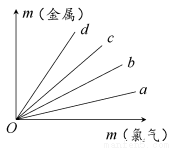
A.a B.b C.c D.d
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题13化学与技术练习卷(解析版) 题型:选择题
开发新材料是现代科技发展的方向之一。下列有关材料的说法正确的是( )
A.氮化硅陶瓷是新型无机非金属材料
B.C60属于原子晶体,用于制造纳米材料
C.纤维素乙酸酯属于天然高分子材料
D.单晶硅常用于制造光导纤维
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com