
| A.金属腐蚀就是金属原子失去电子被还原的过程 |
| B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e→4OH- |
| C.氯碱工业中,阳极发生的反应为:2Cl-–2e→Cl2↑ |
| D.镀锌铁皮的镀层损坏后,铁更容易腐蚀 |
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源:不详 题型:单选题

| A.两个装置之间没有盐桥,故不能形成电流 |
| B.a电极的电极反应式:C2H5OH+16OH--12e-=2CO+11H2O |
| C.一段时间后,乙池d电极周围的溶液呈现棕褐色 |
| D.乙池在反应前后溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池 |
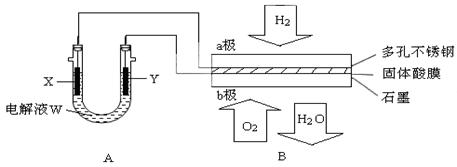
| B.金属棒X的材料应该是比镁活泼的金属 |
| C.金属棒X上发生反应:M一ne一——Mn+ |
| D.这种方法称为牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.Li2NH中N的化合价是-1 |
| B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+和H+的离子半径相等 |
| D.此法储氢和钢瓶储氢的原理相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2PbSO4(s)+2H2O(l),下列说法正确的是
2PbSO4(s)+2H2O(l),下列说法正确的是| A.放电时,负极的电极反应式为:Pb – 2e-=Pb2+ |
| B.放电时,正极得电子的物质是PbO2 |
| C.充电时,电解质溶液中硫酸浓度减小 |
| D.充电时,阴极的电极反应式为:PbSO4 – 2e- +2H2O=PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在铁中加入铬、镍等制成不锈钢 | B.金属护栏表面涂漆 |
| C.汽车底盘喷涂高分子膜 | D.地下钢管连接镁块 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
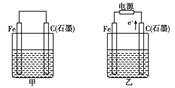
| A.若甲烧杯中盛有NaCl溶液,则石墨棒上的电极反应式为O2+2H2O+4e-= 4OH- |
| B.若乙烧杯中盛有则乙中的总反应为 |
| C.若甲烧杯中盛有CuSO4溶液,则甲中铁棒上的电极反应式为Fe-2e-=Fe2+ |
| D.若起始时乙中盛有200 mL pH=5的CuSO4溶液,一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入0.6 g CuO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com