
| A、①②⑤ | B、②③⑥ |
| C、①②④ | D、②④⑤ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、活化分子之间的碰撞不一定都是有效碰撞 |
| B、升高温度,可使单位体积内活化分子数增多,反应速率加快 |
| C、催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |
| D、对于有气体参加的反应增大压强,可使单位体积内活化分子百分数增加,反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验事实 | 结论 | |
| ① | Cl2的水溶液可以导电 | Cl2是电解质 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| ④ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A、③④ | B、②④ | C、①② | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:F2<Cl2<Br2<I2 |
| B、微粒半径:F->Na+>Mg2+>Al3+ |
| C、酸性HClO4>H2SO4>H3PO4>H2SiO3 |
| D、热稳定性:HF<HCl<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:
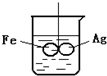 如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )| A、铁圈和银圈左右摇摆不定 |
| B、保持平衡状态 |
| C、铁圈向下倾斜,银圈向上倾斜 |
| D、银圈向下倾斜,铁圈向上倾斜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铜和盐酸的反应:OH-+H+═H2O |
| B、氧化铜和盐酸的反应:Cu2++2H2O═2 H++Cu(OH)2↓ |
| C、铁与硫酸铜溶液的反应:Fe+Cu2+═Cu+Fe2+ |
| D、铁与稀硫酸的反应:Fe+2H+═Fe3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
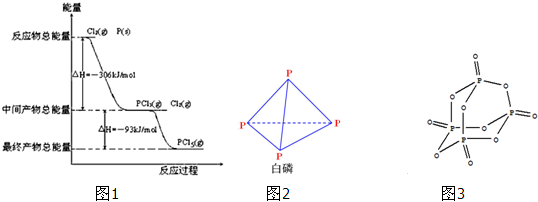
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ?mol-1) | 198 | 360 | 498 | x |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com