
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 900 | 1757 | 14849 | 21007 |
| R | 2081 | 3952 | 6122 | 9370 |
| T | 496 | 4562 | 6912 | 9544 |
| X | 738 | 1451 | 7733 | 10540 |
| Y | 578 | 1817 | 2745 | 11578 |


科目:高中化学 来源: 题型:阅读理解

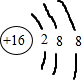
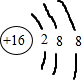
| ||
| △ |
| ||
| △ |
| T/K | 303 | 313 | 323 |
| CA2生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最 小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周 期;E元素原子的最外层电子数是其次外层电子数的
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最 小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周 期;E元素原子的最外层电子数是其次外层电子数的| 3 | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com