
| A. | 浓烧碱溶液中加入铝片:Al+4OH-=AlO2-+2H2O | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | |
| C. | 用铁电极电解氯化铁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| D. | 等体积、等浓度的Ba(OH)2稀溶解与NH4HCO3稀溶液混合Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O |
分析 A.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
B.磁性氧化铁为四氧化三铁,溶于盐酸后生成铁离子和亚铁离子;
C.铁电解电解氯化铁,铁为活性电极,发生氧化反应;
D.等物质的量的氢氧化钡与碳酸氢铵反应生成碳酸钡和一水合氨和水.
解答 解:A.浓烧碱溶液中加入铝片的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故A错误;
B.磁性氧化铁为四氧化三铁,溶于盐酸后生成铁离子和亚铁离子,离子方程式:Fe3O4+8H+═2Fe3++Fe2++4H2O,故B错误;
C.用铁电极电解氯化铁溶液,离子方程式:Fe+2Fe3+$\frac{\underline{\;电解\;}}{\;}$3Fe2+,故C错误;
D.等体积、等浓度的Ba(OH)2稀溶解与NH4HCO3稀溶液混合,离子方程式:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O,故D正确;故选D.
点评 本题考查了离子方程式的正误判断,为高考中的高频题,掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系即可解答,题目难度中等.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
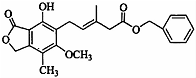
| A. | 分子中所有的原子共平面 | |
| B. | 既可以与FeCl3溶液发生显色反应.又可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 1 mol该化合物最多可以与9mol H2发生加成反应 | |
| D. | 该物质能发生取代反应、氧化反应、加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液在电流作用下电离出自由移动的离子 | |
| B. | 设阿伏加德罗常数为NA,则2.24LCO2气体中所含原子数目为0.3NA | |
| C. | 实验室里将少量金属钠保存在煤油中 | |
| D. | 向某无色溶液中加入少量BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则此溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含 淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含 淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在25℃101KPa下,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 | |
| B. | 表示中和热的化学方程式:H++OH-=H2O△H=-57.3kJ•mol-1 | |
| C. | 将水库中的水闸(钢板)与外加直流电源的正极相连,负极连接到一块废铁上可防止闸被腐蚀 | |
| D. | 已知热化学方程式:S(s)+O2(g)=SO2(g)△H=a kJ•mol-1 S(g)+O2(g)=SO2(g)△H=ba kJ•mol-1 则b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
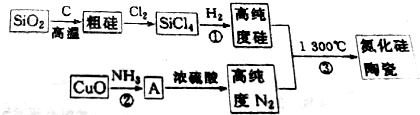
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com