
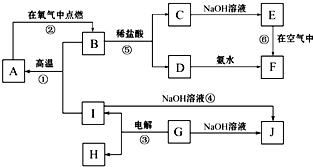
 已知A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族金属元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种金属元素.
已知A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族金属元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种金属元素.
| ||
| ||
| 1000 |
| 27 |
| ||
| 1000 |
| 27 |
| 3 |
| 4 |
| 1000 |
| 36 |
| 1000 |
| 36 |


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
 右图是用铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).
右图是用铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 右图是某有机物分子的比例模型,有关该物质的推断不正确的是( )
右图是某有机物分子的比例模型,有关该物质的推断不正确的是( )| A、分子中可能含有“-OH” |
| B、分子中可能含有“-COOH” |
| C、分子中可能含有“-NH2” |
| D、分子中可能含有“-CH2-” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
| B、将氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| C、金属钠与水反应:Na+H2O=Na++OH-+H2↑ |
| D、实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量的CO2通入NaOH溶液中:CO2+OH-═HCO3- |
| B、氢氧化铁与足量的氢碘酸溶液反应:Fe(OH)3+3H+═Fe3++3H2O |
| C、Na2CO3溶于水呈碱性:CO32-+2H2O?H2CO3+2OH- |
| D、NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3-+Ba2+OH-═BaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com