
| 6.72L |
| 22.4L/mol |
| 4.6g |
| 23g/mol |
| 6.72L |
| 22.4L/mol |
| 4.6g |
| 23g/mol |
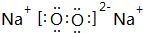 ,
, ;
;
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.250 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1mol CO 2mol H2 | 1mol CH3OH | 2mol CH3OH | |
| 平衡数据 | CH3OH的浓度(mol/L) | c 1 | c 2 | c 3 |
| 反应的能量变化的绝对值(kJ) | a | b | c | |
| 体系压强(Pa) | P1 | P2 | P3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 名称 | 丁烷与 2--甲基丙烷 | 红磷 与白磷 | 庚烷与 十六烷 | 氕与 氘、氚 | 新戊烷与 2,2--二甲基丁烷 | 2--甲基戊烷与 2,3--二甲基丁烷 |
| 相互 关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A、向醋酸溶液加水稀释时,醋酸的电离平衡逆向移动 |
| B、等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| C、a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| D、同浓度CH3COONa和KCN溶液中c(Na+)-c(CH3COO-)小于的c(K+)-c(CN-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com