
| A. | 此合金的熔点、硬度比镁和铝的熔点、硬度都高 | |
| B. | 此合金能全部溶解于稀盐酸中 | |
| C. | 此合金能全部溶解于氢氧化钠溶液中 | |
| D. | 比合金不能全部溶解于过量Fe2Cl3溶液中 |
分析 根据合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;合金的硬度比组成它的纯金属的硬度大,合金的熔点比组成它的纯金属的熔点低,结合金属的化学性质,进行分析判断.
解答 解:A.合金的熔点比各成分金属的低,故A错误;
B.此合金的主要成分是镁和铝,均能与稀盐酸反应,能全部溶解于稀盐酸中,故B正确;
C.此合金属于镁和铝的混合物,铝能与氢氧化钠反应,但镁不能与氢氧化钠反应,此合金不能全部溶解于氢氧化钠溶液中,故C错误;
D.氯化铁的水溶液呈酸性,镁铝与氢离子反应,使平衡正向移动,促进氯化铁的水解,所以合金能全部溶解于过量FeCl3溶液中,故D错误.
故选B.
点评 本题考查金属与合金在性能上的主要差异,难度不大,主要考查合金的特征,掌握合金的特征、金属的化学性质是正确解答本题的关键.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
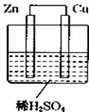 如图所示是 Zn 和 Cu 形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
如图所示是 Zn 和 Cu 形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )| A. | ②④⑤ | B. | ②③④⑤ | C. | ①④⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③②④⑤ | B. | ②①④⑤③ | C. | ②④①⑤③ | D. | ④⑤②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据系统命名法,CH3-CH=CH-CHO的名称是:丁烯醛 | |
| B. | 1 mol HCHO发生银镜反应最多生成2 mol Ag | |
| C. | 对甲基苯甲醛( )使酸性高锰酸钾溶液褪色,说明它含有醛基 )使酸性高锰酸钾溶液褪色,说明它含有醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2S | B. | CuSO4 | C. | NaCl | D. | Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com