W ww.k s5u.co m
班布特罗是一种用于治疗小儿支气管哮喘的药物。它的合成路线如下(ph—表示苯基):
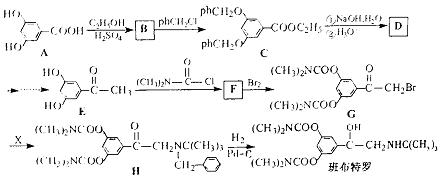
回答下列问题:
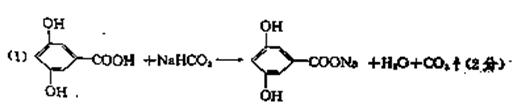
(1)A与过量的NaHCO3溶液反应的化学方程式为 。
(2)F的结构简式为 。
(3)写出满足下列条件的E的一种同分异构体的结构简式 。
①苯的邻二取代物;
②不能与FeCl4溶液发生显色反应;
③水解产物能发生银镜反应。
(4)由G与X(C11H17N)发生取代反应生成H,则X的结构简式为 。
| 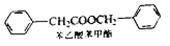
| 
练习册系列答案
相关习题
科目:高中化学
来源:
题型:
纳米TiO2作为一种光催化剂越来越受到人们的关注,现正广泛开发运用。 
(1)制取纳米TiO2的方法很多,氢氧火焰水解法是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解,其化学反应式为: ▲ 。 (2)纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:C2HCl3+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是: ▲ ;通过质谱仪发现还有多种副反物,其中之一为: ,则该有机物核磁共振氢谱有 ▲ 个峰。 ,则该有机物核磁共振氢谱有 ▲ 个峰。 (3)利用半导材料TiO2与染料、铂电极及I 和I-的混合物作电解质(I2+I- 和I-的混合物作电解质(I2+I- I I ),可构成染料敏化太阳能电池(DSSCs)工作原理如右图,该电池工作时,正极的电极反应为: ▲ 。 ),可构成染料敏化太阳能电池(DSSCs)工作原理如右图,该电池工作时,正极的电极反应为: ▲ 。 (4)在不同的载体(钛片、铝片、陶瓷)表面制备二氧化钛薄膜,来考察不同载体TiO2薄膜光催化使甲基橙脱色,每次光照20min取一次样,实验结果如下。  w ww.k s5u. co m w ww.k s5u. co m
下列说法正确的是 ▲ 。 (a)不同载体,无论何种温度一定是钛片最好 (b)约在520℃时,钛片载体的光催化活性最好 (c)无论何种载体,催化活性总是随温度的升高而升高 (d)不同负载TiO2薄膜的光催化活性不同
查看答案和解析>>
科目:高中化学
来源:
题型:
一种将CO2变为燃料或有机化学品的构想分成3个步骤: ①利用浓碳酸钾溶液吸收空气中的CO2; ②将第①步吸收液电解产生H2和O2,同时分离出CO2; ③将第②步产生的H2和CO2在一定条件下转化成CH4和H2O2。 已知:H2(g)+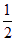 O2(g)=H2O(l) △H1=—285.8kJ/mol O2(g)=H2O(l) △H1=—285.8kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2=—889.6kJ/mol H2O(l)=H2O(g) △H3=+44.0kJ/mol (1)第③步反应的热化学方程式为 。W ww.k s5u.co m | 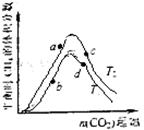
查看答案和解析>>
科目:高中化学
来源:
题型:阅读理解
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下: 
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因 ▲ ,如何用简单方法判断其已洗涤干净 ▲ 。w ww.k s5u. co m (2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是 ▲ 。 (3)用右图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通人氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50~60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→ ▲ 。 
(4)已知反应管中发生的主要反应有:Cr2O3 + 3CCl4 → 2CrCl3 + 3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为 ▲ 。 (5)样品中三氯化铬质量分数的测定 称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。 已知:Cr2O +6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。 +6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。 ①该实验可选用的指示剂名称为 ▲ 。w ww.k s5u. co m ②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是 ▲ 。 ③样品中无水三氯化铬的质量分数为 ▲ 。
查看答案和解析>>
科目:高中化学
来源:2010年江苏省南京市高三第三次模拟考试
题型:填空题
查看答案和解析>>
科目:高中化学
来源:2010年江苏省南京市高三第三次模拟考试
题型:填空题
实验室通常以环已醇为原料在浓硫酸作用下脱水来制备环己烯。
W ww.k s5u.co m 实验步骤下: ①在25mL干燥的圆底烧瓶中加入10g环己醇和0.5mL 98%浓硫酸,充分振荡。 ②向烧瓶中放入2~3粒沸石,安装分馏装置,接收瓶用冰水冷却。 ③小心加热,控制加热速度使温度不超过90℃,直到瓶底剩余少量残渣并出现白雾时停止加热。(已知:环己烯,沸点82.98℃;环己烯—10%水,沸点70.8℃;环己醇—80%水,沸点97.8℃:环己醇-30.5%环己烯,沸点64.9℃) ④向馏出液中加约1g精盐使其达饱和,然后加入2mL饱和碳酸钠水溶液,充分振荡。 ⑤…… ⑥有机层倒入干燥的小锥形瓶中,加入1~2g无水氯化钙干燥。待溶液清亮透明后过滤。 ⑦将滤液移入圆底烧瓶中,加入2~3粒沸石,蒸馏。收集80~85℃馏分,称重约7.4g。 ⑧计算。 请回答下列问题: (1)步骤①中,加入10g环已醇和0.5mL 98%浓硫酸的顺序是 ; (2)步骤③中,为便干控制加热温度,应该采取的加热方法是 ; (3)步骤④中,向馏出液中加约1g精盐使其达饱和的目的是 ; (4)步骤⑤的操作是 ; (5)步骤⑧计算得到的环己烯的产率为 ;分析实制得的环己烯质量低于理论产量可能的原因是 。
查看答案和解析>>
| | | | | |

