
常温下,有体积相同的四种溶液:①pH=2的CH3COOH溶液;②pH=2的硫酸;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
A.①和②混合后:c(H+)=c(CH3COO-)+c(OH-)+2c(SO42-)
B.①和④溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)=0.01mol·L-1
C.②和③混合溶液中:c(SO42-)>c(NH4+ )>c(OH-)>c(H+)
D.四种溶液各稀释100倍,溶液的pH:④>③>①>②
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:填空题
有A、B、C、D、四种短周期元素,它们的原子序数依次增大,已知A和C原子最外层只有一个电子,C单质燃烧时的焰色为黄色,C单质在加热条件下与B的单质充分反应可以产生淡黄色固体化合物,A单质与D单质可以发生化合反应,且反应条件可以是点燃或者光照,试根据以上叙述回答:
(1)写出A、B、C、D的元素符号:A B C D
(2)写出反应的化学方程式:
①A单质与D单质反应: 。
②C单质与B单质在加热的条件下反应: 。
查看答案和解析>>
科目:高中化学 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:实验题
[化学~选修2:化学与技术]
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素。从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害。下图是用高炉烟尘制取硫酸锌的工业流程。

已知:①20℃时,0.1 mol.L-1的金属离子沉淀时的pH
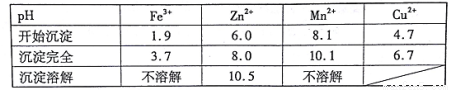
②过二硫酸铵是一种强氧化剂。

回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?
(举出1种) 。
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是 。
(3)加入MnO2的目的是 。
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式 。
(5)写出还原过程发生的主要反应的离子方程式 。
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是 。
A锌粉 B氨水 C( NH4)2CO3 D NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值
查看答案和解析>>
科目:高中化学 来源:2016届吉林省吉林市高三第三次调研理综化学试卷(解析版) 题型:选择题
甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中均含18个电子,甲是气态氢化物,在水中分步电离出两种阴离子,下列推断错误的是
A.若某钠盐溶液含甲电离出的阴离子,则该溶液既可能与酸反应又可能与碱反应
B.若乙与氧气的摩尔质量相同,则乙只能由2种元素组成
C.若丙中含有第2周期ⅣA族的元素,则丙可能是甲烷的同系物
D.若丁中各元素质量比跟甲中各元素质量比相同,则丁中一定含有—1价的元素
查看答案和解析>>
科目:高中化学 来源:2016届四川省雅安市三诊理综化学试卷(解析版) 题型:实验题
工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:

已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | NaCl |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 801 |
回答下列问题:
(1)高温反应前,常在800℃焙烧铝土矿,使固体中水分挥发、气孔数目增多,其作用是 ___(只要求写出一种)。
(2)高温反应后,铝土矿中的氧化物均转变为相应的氯化物,由Al2O3、C和Cl2反应生成AlCl3的化学方程式为 。
(3)气体II的主要成分除了Cl2外,还含有 。气体II常用过量冷的NaOH溶液吸收,吸收液中含有的阴离子主要有 。
(4)工业上为了降低生产成本,生产过程中需要控制加入铝粉的量,“废渣”的主要成分是 。
(5)AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl-4和Al2Cl-7两种离子在电极上相互转化,其它离子不参与电极反应,电镀时阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2016届四川省雅安市三诊理综化学试卷(解析版) 题型:选择题
下列说法错误的是
A.安装燃煤“固硫”装置,可以降低酸雨发生率
B.氮的固定只有在高温、高压、催化剂的条件下才能实现
C.研发易降解塑料,防止白色污染
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
查看答案和解析>>
科目:高中化学 来源:2016届四川省邛崃市高三强化训练一化学试卷(解析版) 题型:选择题
已知KBiO3+MnSO4+H2SO4→Bi2(SO4)3+KMnO4+H2O+K2SO4(未配平),利用上述化学反应设计成如图所示原电池(盐桥中装有含琼胶的饱和K2SO4溶液),下列说法正确的是( )
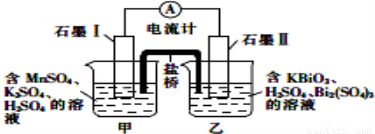
A.电池工作时,电子移向为石墨Ⅰ→溶液→盐桥→溶液→石墨Ⅱ
B.电池工作时,盐桥中的K+移向甲烧杯
C.甲烧杯中发生的电极反应为Mn2+﹣4e﹣+4H2O═MnO4﹣+8H+
D.电池工作一段时间后乙烧杯中溶液的pH增大
查看答案和解析>>
科目:高中化学 来源:2016届四川省宜宾县高三第一次适应性测试理综化学试卷(解析版) 题型:实验题
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:
[实验Ⅰ]NaClO2晶体按如下图装置进行制取。
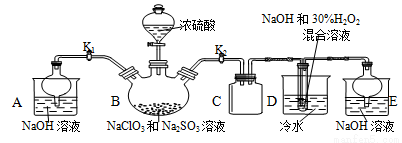
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,
高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C起的是 的作用。
(2)已知装置B中的产物有ClO2气体,装置D中生成NaClO2和一种助燃气体,其反应的化学方程式为 。
(3)从装置D反应后的溶液中获得NaClO2晶体的操作步骤为:①减压在55℃蒸发结晶;
② ;③用38℃~60℃热水洗涤;④低于 ℃干燥;得到成品。.
(4)反应结束后,打开K1,装置A起的作用是 ;如果撤去D中的冷水浴,可能导致
产品中混有的杂质是 。
[实验Ⅱ]样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度:准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣),则所称取的样品中NaClO2的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三5月模拟一理综化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 有白色沉淀生成 | 溶液中不一定含有SO42- |
B | 向Fe(NO3)2溶液中滴入H2SO4酸化的H2O2溶液 | 溶液变为黄色 | 氧化性:H2O2﹥Fe3+ |
C | 将新制氯水和NaBr溶液在试管中混合后,加入CCl4,振荡静置 | 下层呈红棕色 | 氧化性:Cl2﹥Br2 |
D | 向0.1mol·L-1 AgNO3溶液中滴入稀盐酸至不再有沉淀产生,再滴加0.1mol·L-1 NaI溶液 | 先有白色沉淀后变为黄色沉淀 | Ksp:AgI<AgCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com